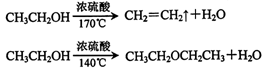
1,2一二溴乙烷可作抗爆剂的添加剂。下图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴。

已知:
相关数据列表如下:

(1)实验中应迅速将温度升高到 左右,原因是 。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中导管d是否发生堵塞,请写出发生堵塞时瓶b中的现象 ;
如果实验中导管d堵塞,你认为可能的原因是 ;
安全瓶b还可以起到的作用是 。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是 。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析可能的原因
(写出两条即可)。
(5)除去产物中少量未反应的Br2后,还含有的主要杂质为 ,要进一步提纯,下列操作中必须的
是 (填入正确选项前的字母)。
| A.重结晶 | B.过滤 | C.萃取 | D.蒸馏 |
(6)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管内,则此时冷水除了能起到冷却1,2一二溴乙烷的作用外,还可以起到的作用是 。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 |
解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为:。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为:。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团: ___________。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团:____________。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有______种氢原子。 |
| (5)综上所述,A的结构简式。 |
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下: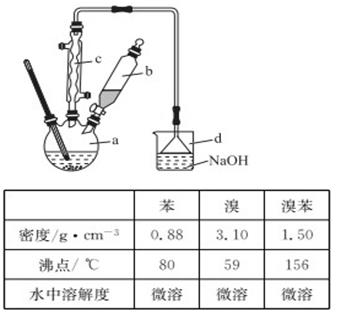
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体,继续滴加液溴滴完。装置d的作用是______________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是____________;
③向分出的粗苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母);
A.重结晶B.过滤C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母)。
A.25 mL B.50 mLC.250 mLD.500 mL
如下图所示,某气体X可能由H2、CO、CH4中的一种或几种组成。将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题:
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是_______________。
(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是______________。
(3)若A、B两个洗气瓶的质量都增加,则气体X可能是(可以不填满)
| ① |
② |
③ |
④ |
⑤ |
实验室用图示装置制取乙酸乙酯。
(1)浓H2SO4的作用是:①_____ _ __,②_____________。
(2)右边收集试管内装有,该溶液的作用是____________________。导气管不能插入液面以下,原因是。加热前,大试管中加入几粒碎瓷片的作用是______________。
(3)制取乙酸乙酯的反应方程式是_______________________________________。
(4)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是_________________。
Ⅰ、某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为。
(2)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是。
(3)若将B中品红溶液换成溴水,通入一段时间后溴水褪色,这说明了二氧化硫具有漂白性,你是否同意这个观点,(填“同意”或“不同意”),说明理由(用离子方程式表示)。
Ⅱ、以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜晶体。其过程如下图所示。
回答下列问题:
(4)配平在滤液(Ⅲ)中发生反应的化学方程式:NOx+H2O+O2=HNO3
(5)写出制取硫酸铜的总反应方程式:。
(6)在上述生产过程中,被循环使用的物质是。