选做【化学—化学与技术】海水是宝贵的自然资源,利用海水水可以得到一系列产品,也可以进行废气处理。
(1)利用氯碱工业产品处理含SO2的烟气的流程如下:

①氯碱工业反应的离子方程式是 。
②上述流程中循环利用的物质是 。
(2)利用海水脱硫可以有效地解决煤燃烧排放的SO2造成的一系列环境问题。其工艺流程如图所示:
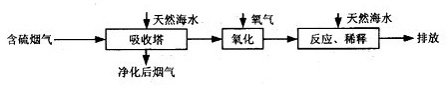
天然海水吸收含硫的烟气后.需要用氧气进行氧化处理,其反应原理的化学方程式是 ;氧化后的海水需要加入氢氰化钠.与之混合后才能排放,该操作的主要目的是 。
(3)从海水中捉纯粗盐后的母液中含有K+、Na+、Mg2+等阳离子,对母液进行一系列的加工可制得金属镁。
①在母液中加入石灰乳反应的离子方程式为 。
②要利用MgCl2·6H2O制得无水氯化镁,应采取的措施是 。
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为同体镁,下列物质中可以用作镁蒸气的冷却剂的是 (填字母)。
| A.Ar |
| B.CO2 |
| C.空气 |
| D.O2 |
E.水蒸气
某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:
(1) 不做任何实验就可以肯定原溶液中不存在的离子是 。
(2) 取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是 ,有关的离子方程式为 。
(3) 取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有 ,有关的离子方程式为 。
(4) 原溶液可能大量存在的阴离子是下列的 。(填序号)
| A.Cl- | B.NO3- | C.CO32- | D.OH- |
Cl2、Br2、I2都具有氧化性,其氧化性Cl2>Br2>I2,Cl2能把溴从溴化物中置换出来,其余类推。
(1)实验室用MnO2制备Cl2的反应中氧化剂是 ,氧化产物是 。将17.4g MnO2与足量的浓盐酸反应,则被氧化的HCl的物质的量为 。
(2)将溴水滴入KI溶液中的化学方程式为 。
(1)已知:2Fe3++2I-===2Fe2++I2, 2Fe2++Br2===2Fe3++2Br-。
①根据以上方程式比较Fe2+、Br-、I-还原性的强弱
②含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________
(2)在硫酸铝、硫酸钾和明矾的1 L混合溶液中,如果SO42-浓度为0.4 mol/L,当加入等体积0.4 mol/L KOH溶液时,生成的沉淀恰好完全溶解,反应后混合溶液中K+的浓度为_______mol/L
(1) 现有三份固体,分别是:
① 纯净的Na2CO3 a mol
② Na2CO3与NaHCO3的混合物共a mol
③ 纯净的NaHCO3 a mol
按要求回答下列问题:
a.分别与盐酸完全反应时,耗酸量从大到小的顺序为________________(填序号,下同)
b.分别和盐酸完全反应时,放出CO2气体的量的大小关系为____________
(2)若将上述(1)中的等物质的量改为等质量,再回答上述a、b两个问题。
a.分别与盐酸完全反应时,耗酸量从大到小的顺序为________________
b.分别和盐酸完全反应时,放出CO2气体的量的大小关系为____________
(3)若将a g Na2CO3和NaHCO3的混合物充分加热,其质量变为b g,则Na2CO3的质量分数为__________。
I. 书写下列反应的化学方程式
(1) 用FeCl3溶液作为腐蚀液刻制铜印刷电路板 ;
(2) 工业上粗硅的制取:
II. 与量有关的离子方程式书写
(1) Ba(OH)2溶液与NaHSO4溶液反应后溶液呈中性:
离子方程式 ;
(2) Ca(HCO3)2溶液与少量NaOH溶液反应
离子方程式 ;
(3) Al2(SO4)3溶液与过量NaOH溶液反应
离子方程式 ;
(学法题)书写此类离子方程式的关键是: 。