二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g·mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注,它不溶于乙醇,难溶于水。实验室制备二氯化一氯五氨合钴的流程及装置如下:
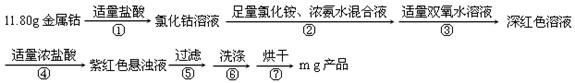
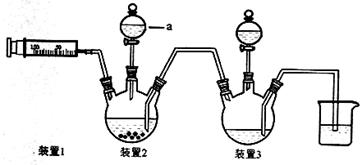
相关信息如下:Co + 2HCl ="=" CoCl2 + H2↑
[Co(NH3)5Cl]2++H2O [Co(NH3)5H2O]3+(深红色)+Cl-
[Co(NH3)5H2O]3+(深红色)+Cl-
请回答下列问题:
(1)写出仪器a的名称 ;向装置2中加入适量盐酸后,关闭活塞进行第①步反应,如何通过装置1判断该反应已经完全 ;在不添加其他试剂的前提下,如何操作能够实现第②步反应 。
(2)第③步加入双氧水的作用是 ;第④步加入适量浓盐酸的作用是 。
(3)第⑥步洗涤操作为:先用冷水洗涤,再用乙醇洗涤。其中乙醇洗涤的目的是 。
(4)第⑦步烘干操作的温度应控制在100-160℃,温度不能过低也不能过高的可能原因是 。
(5)将产品分为10等份,取其中一份于强碱溶液中,加热煮沸,蒸出所有氨气后,向溶液中加酸中和,然后加入0.5000mol·L-1的KI溶液0.04000L(过量),滴加指示剂,用0.1000mol·L-1Na2S2O3溶液滴定,达到终点消耗0.1200LNa2S2O3标准溶液,则该实验产率为 。(2Co3++2I-=2Co2++I2;2S2O32-+I2=S4O62-+2I-)
高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下: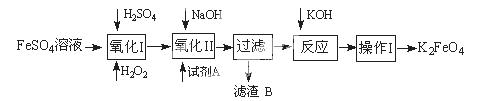
查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定
②溶解度很大,难溶于无水乙醇等有机溶剂
③具有强氧化性,能氧化有机烃、苯胺和80%以下乙醇溶液
回答下列问题:
(1)写出“氧化I”中,生成Fe3+的离子反应方程式。
(2)氧化II中,试剂A为 (填“H2O2”或“HNO3”或“NaClO”);过滤操作中,得到的滤渣B中除NaCl还有
(3)操作I中包括冷却结晶、过滤、洗涤干燥几个步骤。洗涤干燥的目的是脱碱脱水,进行该操作时最好用洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式:K2FeO4 + H2O = Fe(OH)3↓ + KOH +
(5)将一定量的K2FeO4投入一定浓度的FeCl3溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是。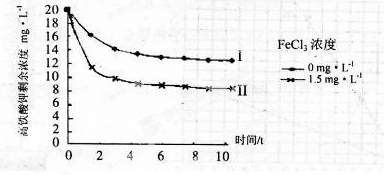
苯酚具有弱酸性,在空气中易被氧化。工业上以苯、硫酸、氢氧化钠、亚硫酸钠为原料合成苯酚的方法可简单表示为: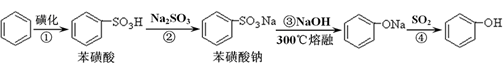
(1)根据上述反应判断下列三种物质的酸性由强到弱的顺序为(填序号)。
A.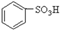 B.
B.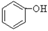 C.H2SO3
C.H2SO3
(2)步骤④与使用CO2相比,使用SO2的优点是(答一个方面)。
(3)经反应④得到的产物除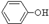 外、可能还含有OH-、SO32-、HSO3-等微粒。请设计实验方案,证明溶液中存在
外、可能还含有OH-、SO32-、HSO3-等微粒。请设计实验方案,证明溶液中存在 、SO32-、HSO3-,写出实验步骤、预期现象和结论。
、SO32-、HSO3-,写出实验步骤、预期现象和结论。
限选仪器及试剂:试管、滴管、玻璃棒、过滤装置和滤纸;2mol·L-1盐酸、1mol·L-1 BaCl2溶液、品红溶液、0.01 mol·L-1酸性KMnO4溶液、1 mol·L-1 FeCl3溶液、饱和溴水等。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量待测液于试管中,加入足量的1 mol·L-1BaCl2溶液,静置、过滤,得滤液和沉淀。将滤液分置于试管A、B中,沉淀置于试管C中。 |
 |
| 步骤2:往试管A中加入 。 |
,说明溶液中含有HSO3-。 |
| 步骤3:往试管B中加入。 |
。 |
| 步骤4:往试管C中加入2 mol·L-1盐酸酸化,再滴入1~2滴品红溶液。 |
,说明溶液中含有SO32-。 |
(4)纯度测定:称取1.00g产品溶解于足量温水中,向其中加入足量饱和溴水(产品中除苯酚外,不含其它与饱和溴水反应生成沉淀的物质),苯酚全部生成三溴苯酚沉淀,经过滤、洗涤、干燥后,称得沉淀质量为3.31g,则产品中苯酚的质量分数为。(苯酚的分子式为C6H6O,三溴苯酚的分子式为C6H3Br3O,它们的相对分子质量分别为94、331)
硫代硫酸钠(Na2S2O3)俗称大苏打,照相业中用作定影剂。Na2S2O3易溶于水,在酸性溶液中与酸反应有单质硫和SO2生成。
(1)Na2S2O3溶液与稀硫酸混合反应可用于探究外界条件对反应速率的影响,完成有关的实验设计表(已知各溶液体积均为5 mL):
| 实验编号 |
T/K |
c(Na2S2O3)/ mol·L-1 |
c(H2SO4)/ mol·L-1 |
实验目的 |
| ① |
298 |
0.1 |
0.1 |
实验①和②探究温度对该反应速率的影响;实验①、③和④探究反应物浓度对该反应速率的影响 |
| ② |
308 |
|||
| ③ |
0.2 |
|||
| ④ |
0.1 |
(2)Na2S2O3还具有很强的还原性,Na2S2O3溶液与足量氯水反应的化学方程式为:
________(提示:S元素被氧化为SO)。
(3)现有一瓶Na2S2O3固体,可能含有Na2SO4固体,请设计实验验证,写出实验步骤、预期现象和结论。限选试剂: 1 mol·L-1 H2SO4、1 mol·L-1 HNO3、1 mol·L-1 HCl、1 mol·L-1 NaOH、0.1 mol·L-1 BaCl2、0.01 mol·L-1 KMnO4、蒸馏水。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量固体于试管中,加蒸馏水溶解 |
|
| 步骤2: |
|
| 步骤3: |
菱镁矿是碱性耐火材料的主要原料,其主要的化学成分是:MgCO3,同时含有杂质:SiO2、Al2O3、Fe2O3、CaO等;目前以菱镁矿为主要原料制备MgSO4的方法如下: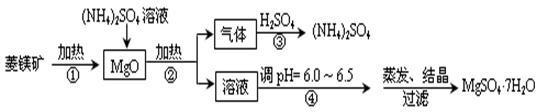
已知:①常温下,Fe3+、Al3+、Mg2+开始形成氢氧化物沉淀和沉淀完全时的pH值如下:
| Fe3+ |
Al3+ |
Mg2+ |
|
| 开始沉淀 |
2.1 |
3.7 |
9.0 |
| 沉淀完全 |
3.2 |
5.2 |
12.4 |
②MgSO4·7H2O在70~80℃时失去3个结晶水,300℃时失去全部的结晶水;
(1)用平衡原理解释:菱镁矿粉粹后加热生成的氧化镁可以溶解在硫酸铵溶液中的原因 。
(2)在该工业流程中,可以循环使用的物质是。
(3)步骤③中氨气和硫酸恰好完全反应,取此时所得的溶液10.00mL配成250mL溶液,配制溶液过程中除烧杯、玻璃棒、胶头滴管、酸式滴定管外,还需要的玻璃仪器有:;经检测所配制的溶液pH=1,c(SO42ˉ)=1.05mol/L,试求算所配制溶液中NH4+ 水解的平衡常数K(写计算过程,计算结果保留三位有效数字)。
(4)在加热条件下杂质中的三氧化二铁溶于硫酸铵的离子反应方程式是:
。
(5)蒸发结晶过程中需要使用60~70℃水浴加热方式,其原因是。
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。
①向其中滴加双氧水,发生反应:H2O2+2H++2Iˉ=2H2O+I2;
②生成的I2立即与试剂X反应,当试剂X消耗完后,生成的 I2才会遇淀粉变蓝因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算:H2O2+2H++2Iˉ= 2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 |
往烧杯中加入的试剂及其用量(mL) |
催化剂 |
开始变蓝时间(min) |
||||
| 0.1 mol·Lˉ1 KI溶液 |
H2O |
0.01 mol·Lˉ1 X溶液 |
0.1mol·Lˉ1 双氧水 |
1mol·L1 稀盐酸 |
|||
| 1 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
无 |
1.4 |
| 2 |
20.0 |
m |
10.0 |
10.0 |
n |
无 |
2.8 |
| 3 |
10.0 |
20.0 |
10.0 |
20.0 |
20.0 |
无 |
2.8 |
| 4 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
5滴Fe2(SO4)3 |
0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2Iˉ= 2H2O+I2反应速率的影响。实验2中m=,n=。
(2)已知,I2与X完全反应时,两者物质的量之比为1∶2。按表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X) ~ t的变化曲线图(进行相应的标注)。
(4)实验4表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂(填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s) 2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。
2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。
(6)已知:N2H4(l) +2H2O2(l)= N2(g)+4H2O(g)△H1= -640kJ/mol
H2O(l)=H2O(g)△H2=+44.0kJ/mol
则0.25mol 液态肼与液态双氧水反应生成液态水时放出的热量是。