下列反应的离子方程式正确的是
| A.向含1mol碘化亚铁的溶液中通入标况下44.8L氯气:2Fe2++2I-+2Cl2=2Fe3++2I2+4Cl- |
| B.铝铵矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液: Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| C.H2O2溶液中滴加酸性KMnO4溶液:2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O |
D.NaHCO3溶液水解的离子方程式为: HCO3-+H2O  CO32-+H3O+ CO32-+H3O+ |
下列对实验操作和实验事实的描述中不正确的说法共有
①燃着的酒精灯不慎碰翻失火,可立即用湿布盖灭
②分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
③不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上稀硼酸溶液
④用托盘天平称量时,所称药品均可放在纸上,并置于天平的左盘
⑤测定溶液的pH时,可用洁净、干燥的玻璃棒蘸取溶液,滴在放置于干净表面皿的pH试纸上,再与标准比色卡比较
⑥将饱和FeC13溶液滴人煮沸的稀氢氧化钠溶液中制取氢氧化铁胶体
| A.2个 | B.3个 | C.4个 | D.5个 |
下列说法可以实现的是
①酸性氧化物均能与碱发生反应 ②弱酸盐溶液与酸反应可以生成强酸
③发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成
④两种酸溶液充分反应,所得溶液呈中性 ⑤有单质参加反应,但该反应不是氧化还原反应
| A.②③④ | B.②③⑤ | C.①④⑤ | D.①②③④⑤ |
某有机物的分子结构如图: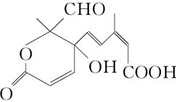
现有试剂:①Na;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2;⑤NaOH;⑥KMnO4酸性溶液。能与该化合物中二个或二个以上官能团都发生反应的试剂有( )
| A.①②⑤⑥ | B.①②④⑥ |
| C.①③④⑤ | D.全部 |
在25 ℃时,将两根铂电极插入一定量的硫酸钠饱和溶液中进行电解,当电路中有a mol电子转移时,溶液中析出m g Na2SO4·10 H2O晶体。若温度不变,在剩余溶液中溶质的质量分数为( )
A. ×100% ×100% |
B. ×100% ×100% |
C. ×100% ×100% |
D. ×100% ×100% |