(12分)实验室制取少量溴乙烷的装置如右图所示。
根据题意完成下列填空: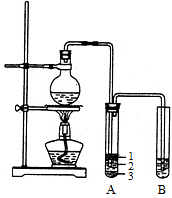
(1)圆底烧瓶中加入的反应物是溴化钠、 和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式 。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是 。试管A中的物质分为三层(如图所示),产物在第 层。
(4)试管A中除了产物和水之外,还可能存在 、 (写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是 (选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是 。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是: 。
下图是实验室用来验证乙烯与氢气反应产物的装置,请回答下列问题: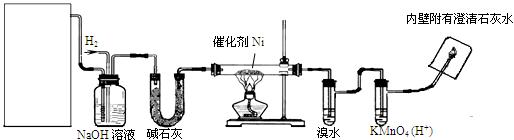
(1)方框内装置用来制取乙烯,其中包括的仪器是:①碎瓷片②石棉网和铁架台
③圆底烧瓶④温度计(量程100℃)⑤温度计(量程200℃)⑥酒精灯⑦单孔塞
⑧双孔塞⑨导管。不选用的仪器有(填序号)
(2)写出实验室制乙烯化学方程式:
(3)碱石灰的作用是:________________________________________________
(4)实验过程中,发现溴水会褪色,可能的原因是:_____________________________
(5)出现什么现象可说明生成了乙烷?________________________________________
(10分,每空2分)甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为(提示:H2C2O4的一级电离平衡常数为5.4×10-2)
 。
。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表: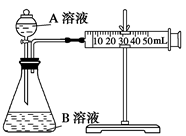
| 序号 |
A溶液 |
B溶液 |
| ① |
2 mL 0.1 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液 |
| ② |
2 mL 0.2 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液 |
| ③ |
2 mL 0.2 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
该实验探究的是对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是(用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。
取两支试管各加入2 mL 0.1  mol/L
mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合
H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合 并振荡,记录溶液褪色所需时间。该实验目的是研究对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是。
并振荡,记录溶液褪色所需时间。该实验目的是研究对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是。
现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。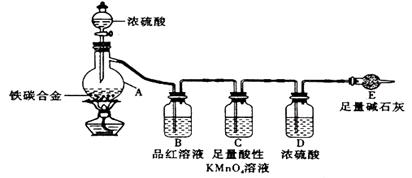
Ⅰ探究浓硫酸的某些性质:
⑴按图示的连接装置,检查装置的气密性,称量E的质量。
⑵将a g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为________。未点燃酒精灯前,A、B均无明显现象,其原因是:_____________________________。
⑶点燃酒精灯一段时间后,A、B中可观察到明显的现象。写出A中发生反应的化学方程式________________________________(只写一个)。B中的现象是______________,由此可得到浓硫酸具有____________性。
⑷随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式______________(只写一个)。
⑸反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是______ _______________________________。
_______________________________。
Ⅱ测定铁的质量分数:
⑹待A中不再逸出气体时,停止加 热,拆下E并称重。E增重b g。铁碳合金中铁的质量分数为_____________________(写表达式)。
热,拆下E并称重。E增重b g。铁碳合金中铁的质量分数为_____________________(写表达式)。
⑺某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。
为了快速和准确的计算出铁的质量分数,最简便的实验操作是__________(填写代号)。
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.测定反应前后装置和药品的总质量。
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称取a g样品,置于烧杯中;
②加适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;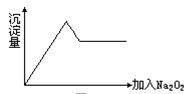 ⑦……。
⑦……。
请根据上面叙述,回答:
(1)上图仪器中,实验步骤①②③中必须用到的仪器是E和
(填仪器序号)
(2)写出步骤③中发生反应的离子方程式
(3)步骤④中如何证明沉淀已完全?
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为 ________________________。
(共17分)Ⅰ、一无色透明的溶液做如下实验:
ⅰ取少量溶液滴加盐 酸酸化的BaCl2溶液,只观察到有白色沉淀生成。
酸酸化的BaCl2溶液,只观察到有白色沉淀生成。
ⅱ另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成 沉淀的量的关系如图所示:
沉淀的量的关系如图所示: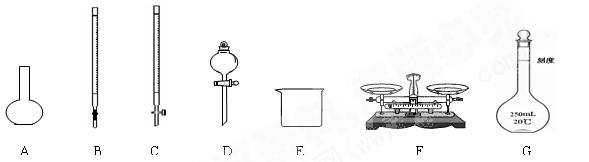 试问:
试问:
(1)Cu2+、NH4+、Al3+、Mg2+、Na+、Fe3+、CO32-、K+、SO42-等离子中一定存在的离子是____、____、______;可能存在的离子是_______、_____;一定不存在的是______、____、_____、____。
(2)上述溶液至少由__________、_________等物质混合成。(填化学式)
Ⅱ、甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
| 物质 |
燃烧热(kJ·mol-1) |
| H2(g) |
-285.8 |
| CO(g) |
-283.0 |
| CH4(g) |
-890.3 |
已知1molH2O(g)转变为1molH2O(l)时放出44.0 kJ热量。
⑴写出CO燃烧的热化学方程式。
⑵ 2H2(g) + O2(g)="=" 2H2O(g)△H=kJ/mol