(15分)四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y[ |
|
| |
Z |
W |
请回答下列问题:
(1)元素Z位于周期表中第________周期________族。
(2)这些元素的氢化物中,水溶液碱性最强的是_____________(写化学式)。
(3)XW2的化学式为________。
(4)Y的最高价氧化物的化学式为________。
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实。根据以下化学反应框图填空:
 |
(1)写出A的电子式;C的结构简式;
(2)写出苯和液溴反应生成E的化学方程式;
其反应类型为。
已知某有机物的相对分子质量为58。根据下列条件回答:
若该有机物的组成只有C、H,则此有机物的分子式为;若它的核磁共振氢谱只有2个峰,则它的结构简式为。
乙烯与乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃
后充分反应,乙烯和乙烷全部消耗完,得到CO到CO2的混合气体和45g水。试求:
⑴ 当a =1时,乙烯和乙烷的物质的量之比n (C2H4)∶n (C2H6)= 。
⑵ 当a =1,且反应后CO和CO2混合气体的物质的量为反应前氧气的3/2时,则
b= ,得到的CO和CO2的物质的量之比n (CO)∶n (CO2)= 。
⑶a的取值范围是 。
⑷b的取值范围是 。
某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,通过计算回答:
(1)混合气体中气态烷烃的化学式: ,
(2)混合气体中两种气体的物质的量之比: ,
(3)写出混合气体中气态烯烃可能的结构简式: 。
( 8分 ) 化合物A和E都是医用功能高分子材料,且有相同的元素百分组成,均可由化合物A ( C4H8O3 ) 制得,如下图所示,B和D互为同分异构体。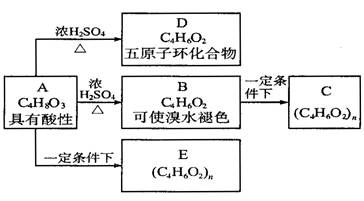
( 1 ) 试写出化学方程式:
A D: ____________________________________________________________ ;
D: ____________________________________________________________ ;
B C: ____________________________________________________________。
C: ____________________________________________________________。
( 2 ) 反应类型 A B ___________ ; B
B ___________ ; B C ___________ ;A
C ___________ ;A  E _________ 。
E _________ 。
( 3 ) E的结构式 __________________ 。
( 4 ) A的同分异构体 ( 同类别且有支链 ) 的结构式: _________ 及 ________ 。