某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,通过计算回答:
(1)混合气体中气态烷烃的化学式: ,
(2)混合气体中两种气体的物质的量之比: ,
(3)写出混合气体中气态烯烃可能的结构简式: 。
(14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。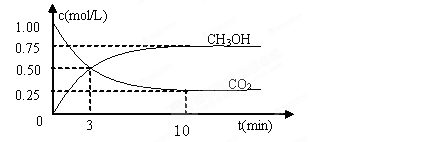
①反应开始到平衡,H2的平均反应速率v(H2)=_____mol/(L·min)。H2的转化率为。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 H2 |
E、使用催化剂 F、缩小容器体积
⑵①反应进行到3分钟时, 同种物质的v正与v逆的关系: v正v逆 (填>,=,<)
同种物质的v正与v逆的关系: v正v逆 (填>,=,<)
②上述反应平衡常数的表达式为,经计算该温度下此反应平衡常数的数值为。
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH值升高的原因是HCO3—的水解程度增大,故碱性增强,该反应的离子方程式为 。
。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀, 则乙判断正确。试剂X是。A、Ba(OH)2溶液 B、NaOH溶液 C、BaCl2溶液 D、澄清石灰水
则乙判断正确。试剂X是。A、Ba(OH)2溶液 B、NaOH溶液 C、BaCl2溶液 D、澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH(填“高于”、“低于”或“等于”)8.3,则甲判断正确。
炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结合时 生成剧毒的HCN。完成下列问题:
生成剧毒的HCN。完成下列问题:
(1)HCN的水溶液酸性很弱,则HCN电离方程式为_________________,NaCN的水溶液呈碱性是因为_________________(用离子方程式表示)。
(2)室温下,如果将0.2mol NaCN和0.1mol HCl全部溶于水,形成混合溶液(假设无损失),①___和___两种粒子的物质的量之和等于 0.2mol。②___和___两种粒子的物质的量
0.2mol。②___和___两种粒子的物质的量 之和比H+多0.1mol。
之和比H+多0.1mol。
(3)已知某溶液中只存在OH-、H+、Na+、CN-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c(CN-)>c(Na+)>c(H+)>c(OH-) | B.c(Na+)>c(CN-)>c(OH-)>c(H+) |
| C.c(CN-)>c(H+)>c(Na+)>c(OH-) | D.c(CN-)>c(Na+)>c(OH-)>c(H+) |
①若溶液中只溶解了一种溶质,上述离子浓度大小顺序关系中正确的是(填序号)。
②若上述关系中C是正确的,则溶液中溶质的化学式是__和_。
③若该溶液中由体积相等的稀HCN溶液和NaOH溶液混合而成,且恰好呈中性,则混合前
c(HCN)c(NaOH)(填“>”、“<”、或“=”下同),
混合后溶液中c(Na+)与c(CN-)的关系c(Na+)c(CN-)。
(4分)在发射“神舟 ”七号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热。已知:
”七号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热。已知:
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH =-641.6 kJ/mol
H2O(l)===H2O(g) ΔH =+44 kJ/mol
若用3.2 g液态肼 与足量过氧化氢反应生成氮气和液态水,则整个过程中转移的电子的物质的量为__________,该反应的热化学方程式
与足量过氧化氢反应生成氮气和液态水,则整个过程中转移的电子的物质的量为__________,该反应的热化学方程式 为。
为。
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下表.请回答:
| 温度/℃ |
200 |
300 |
400 |
500 |
600 |
| 氨含量/% |
89.9 |
71.0 |
47.0 |
26.4 |
13.8 |
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是______________________________________.
(2)在一定温度下,将2molN2和6 molH2通入到体积为1 L的密闭容器中,发生反应N2+ 3H2 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=_________;该温度下的平衡常数K=___________(用分数表示);欲使K增大,可以采取的措施是_______.
2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=_________;该温度下的平衡常数K=___________(用分数表示);欲使K增大,可以采取的措施是_______.
(3)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是____(选填序号字母);从化学反应速率的角度分析,提高反应速率可采取的措施是_____(选填序号字母).
a.及时分离出NH3 b.升高温度 c.增大压强 d.使用催化剂