某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
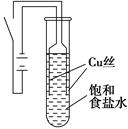
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
| 物质 |
氯化铜 |
氧化亚铜 |
氢氧化亚铜(不稳定) |
氯化亚铜 |
| 颜色 |
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 |
红色 |
橙黄色 |
白色 |
*相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e-¯ ═ H2↑+ 2OH-¯
C.电解过程中氯离子移向阳极
D.试管底部红色的固体具有还原性
下列物质间转化都能通过一步实现的是
| A.Si→SiO2→H2SiO3→Na2SiO3 |
| B.Al→Al2O3→NaAlO2→Al(OH)3 |
| C.S→SO3→H2SO4→SO2 |
| D.N2→NO2→HNO3→NO |
制造硫酸的工艺流程反应其中之一是2SO2(g)+O2(g)←→2SO3(g)+190 kJ。下列描述中能说明上述反应已达平衡的是
| A.v(O2)正=2v(SO3) |
| B.容器中气体的平均摩尔质量不随时间而变化 |
| C.如果容器容积是固定的,那么混合气体的密度不随时间而变化 |
| D.单位时间内生成n mol SO3的同时生成n mol O2 |
将可逆反应:2NO2←→2NO+O2在固定容积的密闭容器中进行,达到平衡的标志是
①单位时间内消耗n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,消耗2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的密度不再改变的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.②⑤⑥ |
水煤气反应C(s)+H2O(g) ←→CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率增大的是
| A.增加C的量 |
| B.将容器的体积缩小一半 |
| C.保持体积不变,充入N2使体系压强增大 |
| D.保持体积不变,将生成的H2及时移出容器 |
研究小组发现一种化合物在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4 min~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是
| A.2.5 μmol·L-1·min-1和2.0 μmol·L-1 |
| B.2.5 μmol·L-1·min-1和2.5 μmol·L-1 |
| C.3.0 μmol·L-1·min-1和3.0 μmol·L-1 |
| D.5.0 μmol·L-1·min-1和3.0 μmol·L-1 |