天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为CoO2+LiC6 LiCoO2+C6,下列说法正确的是
LiCoO2+C6,下列说法正确的是
| A.充电时,电池的阴极反应为LiC6-e-===Li++C6 |
| B.放电时,电池的正极反应为CoO2+Li++e-===LiCoO2 |
| C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质 |
| D.锂离子电池的比能量(单位质量释放的能量)低 |
下列气态氢化物中稳定性最弱的
| A.SiH4 | B.PH3 | C.H2S | D.HF |
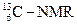 (核磁共振)可以用于含碳化合物的结构分析,
(核磁共振)可以用于含碳化合物的结构分析,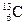 表示的碳原子
表示的碳原子
| A.核外有13个电子 |
| B.核内有6个质子,核外有7个电子 |
C.质量数为13,原子序数为6,核内有7 个质子 个质子 |
| D.质量数为13,原子序数为6,核内有7个中子 |
下列各组元素性质递变情况错误的是
A.Li、B、Be原子最外层电子数依次增多 B.P、S、Cl元素最高正化合价依次升高
C.N、O、F原子半径依次增大 D.Na、K、Rb的金属性依次增强
D.Na、K、Rb的金属性依次增强
提出元素周期律并绘制了第一个元素周期表的科学家是
| A.戴维 | B.阿伏加德罗 | C.门捷列夫 |
D.道尔顿 |
属于氮的固定的化学反应是
| A.N2与H2在一定条件下反应生成NH3 | B.硝酸工厂用NH3氧化制NO |
| C.NO转化为NO2 | D.由NH3制碳酸氢铵和硫酸铵 |