CO是水煤气的主要成份之一,是一种无色剧毒气体,根据信息完成下列各题
Ⅰ、已知下列热化学方程式
2C(s) + O2(g) = 2CO(g) △H = -221kJ/mol
C(s) + O2(g) = CO2(g) △H = -393kJ/mol
24g单质碳在不足量的O2中燃烧时,生成等物质的量的CO和CO2气体,则和24g单质碳完全燃烧生成CO2相比较,损失热量_________kJ
Ⅱ、850℃时,在10L体积不变的容器中投入2molCO和3molH2O,发生如下反应:
CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
当CO的转化率达60%时,反应达平衡
(1)850℃时,该反应的平衡常数为_________
(2)该条件下,将CO和H2O都改为投入2mol,达平衡时,H2的浓度为_________mol/L,下列情况能说明该反应一定达平衡的是_________
| A.CO和H2O蒸气的浓度之比不再随时间改变 |
| B.气体的密度不再随时间改变 |
| C.CO和CO2的浓度之比不再随时间改变 |
| D.气体的平均摩尔质量不再随时间改变 |
Ⅲ、为防止CO使人中毒,一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇——氧化钠,其中O2-可以在固体NASICON中自由移动,则:
(1)该原电池中通入CO的电极为_________极,该电极的电极反应式为___________________
(2)通空气一极的电极反应式为____________________________________
已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是;
(2)B和C的分子式相对稳定的是;
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。该反应的化学方程式为。
(4) 若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是。
氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下: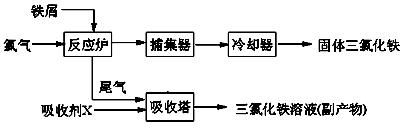
(1)试写出吸收塔中反应的离子方程式:____________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH20) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是:。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)FeCl3的质量分数通常可用碘量法测定:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c mol/L Na2S2O3溶液滴定用去V mL。
( 已知:2Fe3++2I-= I2+2Fe2+I2+2S2O32-=2I- +S4O62-)
①滴定终点的现象是:____________________________。
②样品中氯化铁的质量分数为__________________。
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法: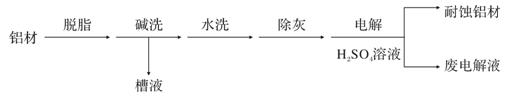
① 碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是____(用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的____.。
a.NH3 b.CO2 c.NaOH d.HNO3
② 以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为____。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生此现象的原因(用离子方程式表示)_____。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极材料的原因是______。
(3)利用下图装置,可以模拟铁的电化学防护。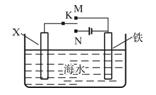
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚(CH3OCH3)。
请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:(甲醇:CH3OH)
① 2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
则利用水煤气合成二甲醚的总反应的热化学方程式为______________________.
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(2)、 已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)
(2)④、⑤、⑥、⑦五种溶液中NH4+浓度由大到小的顺序是(填序号)
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=。