(16分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数Ka分别为: 7.1×10-4, 2.98×10-8。将0.1mol/L的亚硝酸稀释100倍,c(H+)将 (填“不变”、“增大”、“减小”);Ka值将(填“不变”、“增大”、“减小”) 。写出HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的离子方程式 。
(2)羟胺(NH2OH) 可看成是氨分子内的l 个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。已知NH2OH 在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因 。
(3)亚硝酸钠与氯化钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生一种红棕色刺激性气味气体和一种无色刺激性气味气体,该反应的离子方程式为 。
(4)磷及部分重要化合物的相互转化如图所示。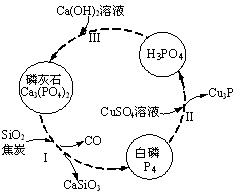
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为 。
(5)若处理后的废水中c(PO43-)=4×10-7 mol·L-1,溶液中c(Ca2+)= mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
(6)某液氨-液氧燃料电池示意图如下,该燃料电池的工作效率为50%,现用作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3 mol·L-1,则该过程中消耗氨气的质量为 。(假设溶液电解前后体积不变)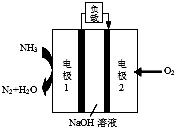
(12分)下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一。
请回答下列问题:
(1)H中含有的化学键类型是________________________。
(2)上述框图所示的反应中,既属于化合反应,又属于氧化还原反应的反应共有______个;反应③的离子方程式____________________________。
(3)25℃时,以Pt为电极电解含有少量酚酞的F的饱和溶液,若在溶液变红的一极收集到0.2 g气体,则此时溶液的pH是_______(假设溶液的体积为2 L且不考虑电解后溶液体积的变化)。
(4)J溶液显_______(填“酸”、“碱”或“中”)性,原因是_________________________。(用离子方程式表示)
(16分)用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下(部分操作和条件略):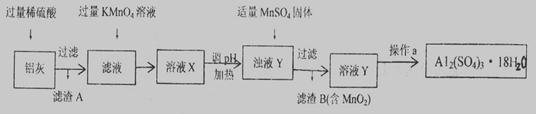
已知:一定条件下,MnO4 可与Mn2+反应生成MnO2
可与Mn2+反应生成MnO2
(1)稀H2SO4溶解Al2O3的离子方程式是__________________。
(2)已知:生成氢氧化物沉淀的pH如下表(注:金属离子的起始浓度为0.1mol·L-1)
上述流程中,加入过量KMnO4溶液的作用是________________________。(用离子方程式表示)
(3)向滤渣B中加入浓盐酸并加热,能说明沉淀中存在MnO2现象是____________。
上述流程中加入MnSO4体的目的是________________________。
操作a由一系列操作组成,分别是________、________、过滤。
(4)若用沉淀溶解平衡原理分析,操作a能析出A12(SO4)3·18H2O的原因是①____________②___________________
(17分)氢气和氨气都属于无碳清洁能。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2 MH2x(s)△H<0(M表示某种合金)
MH2x(s)△H<0(M表示某种合金)
下图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是_____________
a.T1>T2
b.增大氢气压强,加快氢气的吸收速率
c.增大M的量,上述平衡向右移动
d.在恒温、恒容容器中,达平衡后充入H2,再次平衡后的压强增大
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体。乙装置中a、b为石墨电极,电解过程中,b极质量增加。
①工作过程中,甲装置中d电极上的电极反应式为_____________________________。
②若用该装置电解精炼铜,则b极接____(填“粗铜”或“精铜”);若用该装置给铁制品上镀铜,则____(填“a”或“b”)极可用惰性电极(如Pt电极),若电镀量较大,需要经常补充或更换的是_______。
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质。
已知:N2(g)十3H2(g)  2NH3(g)△H=
2NH3(g)△H= 92.4kJ·mol-1
92.4kJ·mol-1
2H2(g)十O2(g)=2H2O(1)△H= 572KJ·mo1-1
572KJ·mo1-1
试写出氨气在氧气中燃烧生成液态水的热化学方程式___________________。
(4)在一定条件下,将lmotN2和3molH2混台于一个10L的密闭容器中发生反应:
N2(g)十3H2(g)  2NH3(g)
2NH3(g)
5min后达到平衡,平衡时氮气的转化率为 。
。
①该反应的平衡常数K=________,(用含 的代数式表示)
的代数式表示)
②从反应开始到平衡时N2的消耗速率v(N2)=____mo1·L-1·min-1。(用含 的代数式表示)
的代数式表示)
(15分)I(10分)A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为___________(填元素符号)
(2)若D是金属,C溶液在储存时应加人少最D,其理由是(用必要的文字和离子方程式表示)_____________________;
(3)若A、B、C为含同一种金属元素的无机化合物.在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子力程式_________________________________________。化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E的混合物投人500m1稀硫酸中,固体全部溶解并产生气体。待反应完全后.向所得溶液中加人NaOH溶液,生成沉淀的物质的是与加人溶液的体积关系如下图所示。则固体混合物中Mg的质量为_____________;NaOH溶液的物质的量浓度为___________。
II(5分)某一离子反应体系有反应物和产物共以下六种:
已知该反应中的H2O2只发生如下过程: 
(1)该反应中的还原剂是___________。
(2)该反应中发生还原反应的过程是_____→_____。
(3)溶液随着酸性的增强氧化性不断增强,应选择__________(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(4)如反应转移了0.6mo1电子,则产生的气体在标准状况下体积为__________。
(131分)某利,盐溶解后得到的溶液中,可能含有Fe2+、Fe3+、SO42-、NH4+、Ba2+、CO32-离子中的某几种。
(1)甲同学做如下实验:①取少量溶液于试管中逐滴加人浓氢氧化钠溶液,发现先生成白色沉淀,迅速变为灰绿色,最后变为红揭色,并有刺激性气体生成;②另取少量溶液于试管中,加人少量盐酸酸化的氯化钡溶液,有白色沉淀生成。该溶液中一定含有的离子是_____;写出①中白色沉淀转化为红褐色沉淀的化学方程式__________________。
(2)乙同学做如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2发现溶液变红色。继续滴加H2O2,红色逐渐褪去且有气泡产生。为弄清其中缘由,他查阅资料知:
①该反应中,被氧化的元素为__________,每生成1molCO2转移的电子数为___________;
②根据乙同学的实验现象,请判断还原性强弱为:Fe2+__________SCN-(填<、=或>);
③根据资料,乙同学提出的猜想是:H2O2将SCN-氧化使红色逐渐褪去。请你设计一个实验,验证乙同学的猜想是否正确_____________________________________________。