研究NO2、SO2 等大气污染气体的处理具有重要意义。
(1)铜与浓硝酸反应生成NO2的化学反应方程式是 。
(2)NO2可用水吸收,该反应的化学反应方程式是 。
(3)工业上可将SO2通入浓的Fe2(SO4)3溶液中来治理污染得副产物绿矾和硫酸,写出该反应的离子方程式 。
(4)利用反应6NO2 + 8NH3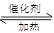 7N2 + 12H2O也可处理NO2。当反应转移0.6mol电子时,则消耗的NH3在标准状况下的体积是 L。
7N2 + 12H2O也可处理NO2。当反应转移0.6mol电子时,则消耗的NH3在标准状况下的体积是 L。
(5)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1=" -" 196.6 kJ·mol-1
2SO3(g) ΔH1=" -" 196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH2=" -" 113.0 kJ·mol-1
2NO2(g) ΔH2=" -" 113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的
SO3(g)+NO(g)的
ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以物质的量之比1∶2置于恒容密闭容器中发生上述反应。
①下列能说明反应达到平衡状态的是( )。
| A.体系压强保持不变 | B.SO3和NO的体积比保持不变 |
| C.混合气体颜色保持不变 | D.每消耗1 mol SO3的同时消耗1 mol NO2 |
②测得上述反应平衡时NO2与SO2物质的量之比为1∶11,该反应的平衡常数K = (保留1位小数)。
已知,在常温常压条件下,氢气的热值为143kJ/g,请写出该条件下H2燃烧的热化学方程式 ▲。
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
A甲+H2O 乙+丙 B乙
乙+丙 B乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表里的位置是_____________。
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为__________。
③将以上两种金属单质用导线连接,插入NaOH溶液构成原电池,则负极发生的电极反应为___________________________。
(2)若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙 丙。则:
丙。则:
①甲的结构式为_____________。
②写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式________________________。
回答下列有关问题:
(1)硫化铵水解的离子方程式为:S2-+NH4++H2O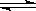 HS-+ NH3·H2O,
HS-+ NH3·H2O,
如何判断溶液的酸碱性:。
(2)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是:。有人认为加入FeS作为沉淀剂还可以起到净化水的作用,请你运用所学知识解释:
。
(3)用离子方程式解释泡沫灭火器(将硫酸铝与碳酸氢钠溶液混和)灭火原理:
。
写出除去下列气体中少量杂质(括号内物质)的方法:
⑴N2(O2);⑵NO(NO2);
⑶CO2(HCl);⑷NH3(H2O)。
有机物A为绿色荧光蛋白在一定条件下水解的最终产物之一,结构简式为: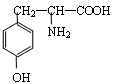
请回答下列问题:(1)A的分子式为。
(2)A与氢氧化钠溶液反应的化学方程式为。
(3)已知:
两个A分子在一定条件下生成的化合物结构简式为。(4)符合下列4个条件的同分异构体有6种,写出其中三种。①1,3,5-三取代苯②遇氯化铁溶液发生显色反应③氨基与苯环直接相连④属于酯类