应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质。下列预测中正确的是
①Be的氧化物的水化物可能具有两性
②Tl与盐酸和NaOH溶液作用均能产生氢气
③At单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥H2Se是无色、有毒、比H2S稳定的气体
| A.①②③④ | B.②④⑥ | C.①③⑤ | D.②④⑤ |
在密闭容器中进行反应:A(g)+3B(g) 2C(g),有关下列图像的说法不正确的是
2C(g),有关下列图像的说法不正确的是 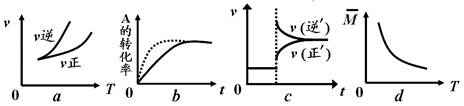
| A.依据图a可判断正反应为放热反应 |
| B.在图b中,虚线可表示使用了催化剂 |
| C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 |
| D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
将BaO2放入密闭真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
| A.平衡常数减小 | B.BaO2量不变 |
| C.氧气压强不变 | D.BaO量不变 |
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成下图所示的原电池装置。
2Fe2++I2设计成下图所示的原电池装置。
下列判断不正确的是
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极 |
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应方程如下:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)。下列叙述错误的是
CH3CH2OH(g)+3H2O(g)。下列叙述错误的是
| A.使用合适的催化剂可大大提高生产效率 |
| B.由反应需在300℃进行,可知该反应是吸热反应 |
| C.增大原料气中CO2的百分含量,可以提高H2的转化率 |
| D.70MPa的压力,不仅可以增加单位时间内的产出,还可以提高CO2和H2的利用率 |
用惰性电极进行电解,下列说法正确的是
| A.电解稀硫酸溶液,实质上是电解水,故溶液中c(H+)不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液中c(OH-)减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1∶2 |
| D.电解硝酸银溶液,在阴极上和阳极上析出的产物的物质的量之比可能不为4∶1 |