下列分子中的所有碳原子均在同一条直线上的是:
| A.CH3CH2CH2CH3 |
| B.CH3 — CH=CHCH3 |
C.HC≡C—CH2 |
| D.CH3—C≡C—C≡C—CH3 |
2008年8月8日点燃奥运会主火炬。火炬以中国传统祥 云符号和纸卷轴为创意,火炬使用的燃料为丙烷。已知25℃,101kPa下,拆开1molC-H中的
云符号和纸卷轴为创意,火炬使用的燃料为丙烷。已知25℃,101kPa下,拆开1molC-H中的
化学键要吸收415kJ的能量,1molC-C中的化学键要吸收
331kJ的能量,拆开1molO2中的O=O键要吸收498kJ的能
量,形成水分子中的1mol H-O键要放出465 kJ的能量,
形成二氧化碳分子中的1mol C=O键要放出798kJ的能量
(丙烷燃烧过程中不考虑其它能量转化)。下列说法正确
的是()
| A.火炬中丙烷完全燃烧的热化学方程式为C3H8+5O2=3CO2+ 4H2O;△H=-2036kJ/mol |
| B.C3H8(g)+ 5O2(g)=3CO2(g)+ 4H2O(g);△H<-2036kJ/mol |
| C.火炬中丙烷完全燃烧的热化学方程式为:C3H8(g)+ 5O2(g)=3CO2(g)+ 4H2O(g);△H=2036kJ/mol |
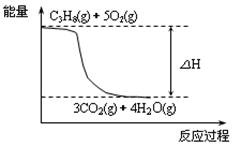
| D.火炬中丙烷燃烧的能量变化可用如下图所示表示 |
下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是()
| 编号 |
化学反应 |
离子方程式 |
评价 |
| A |
向硫酸铝溶液加入过量的氨水 |
Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
正确,氢氧化铝两性氢氧化物 |
| B |
碳酸钠溶液中滴加过量的盐酸 |
CO32-+2H+=" " CO2↑+H2O |
正确 |
| C |
石灰水反应滴加少量NaHCO3溶液 |
HCO3-+Ca2++OH-= CaCO3↓+H2O |
错误,不满足Ca(OH)2的配比 |
| D |
硫酸氢钠溶液与足量氢氧化钡溶液混合 |
2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O |
正确 |
某溶液中含有HCO3-、SO32-、SiO32-、Cl-等四种离子,若向其中加入某种试剂后,发现溶液中
仅有HCO3-、SO32-两种离子数量大量减少。则加入的试剂可能是( )
| A.盐酸 | B.过氧化钠 | C.双氧水 | D.氯化钡溶液 |
某澄清透明的浅黄色溶液中Fe3+,可能含有下列八种离子:H+、NH4+、Ba2+、Al3+、SO42-、HCO3-、
I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括K+和OH-)有()
| A.4种 | B.5种 | C.6种 | D.7种 |
下列离子方程式正确的是()
| A.碳酸氢钠溶液与少量石灰水反应 HCO3-+Ca2++OH-===CaCO3↓+H2O |
B.氯化铵与氢氧化钠两种溶液混合加热 OH-+NH4+ H2O+NH3↑ H2O+NH3↑ |
| C.氢氧化镁与稀硫酸反应 H++OH-===H2O |
| D.单质铜与稀硝酸反应 Cu+2H++2NO3-===Cu2++2NO↑+H2O |