为了探究Cu(NO3)2的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
回答下列问题:
Ⅰ.Cu(NO3)2的氧化性
将光亮的铁丝伸入Cu(NO3)2溶液中,充分反应后将铁丝取出。为检验铁的氧化产物,进行如下实验。(可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水)
(1)请完成下表:
| 操作 |
现象 |
结论 |
| 取少量溶液于试管中,加入KSCN溶液,振荡 |
① |
不存在Fe3+ |
| 另取少量溶液于试管中,加入 ② ,振荡 |
蓝色沉淀 |
存在Fe2+ |
【实验结论】Cu(NO3)2能将Fe氧化为Fe2+。
Ⅱ.Cu(NO3)2的热稳定性
用下图所示的实验装置A加热Cu(NO3)2固体,产生红棕色气体,试管中残留物为黑色固体,b中收集到无色气体。
(2)仪器a的名称是 。装置B的作用是 。
(3)【提出设想】b中收集到的无色气体可能是:
i.氧气 ⅱ.一氧化氮 ⅲ.空气
【实验验证】该小组为验证上述设想,用玻璃片在水下盖住集气瓶口,并取出正放在桌面上,移开玻璃片后瓶口未发现颜色变化,将带火星的木条伸入集气瓶,未见复燃。
【实验结论】b中的气体是 。根据上述实验结果,该小组得出了Cu(NO3)2固体加热分解的产物。请你帮助写出Cu(NO3)2加热分解的化学方程式 ;
C中反应的离子方程式 。
长期烧水的壶内侧会有一层黄色的固体物质附着,即水垢[主要成分是CaCO3和Mg(OH)2].水垢的产生会造成传热能力减弱而使大量热损失,因此水垢应定期除去.请用家中必备物质设计一套除垢方案,并写出涉及的离子方程式。
(1)推断出A是___________,B是___________,C是___________。
(2)室温时C溶液的pH___________7(填>、=、<=)。
(3)写出A与B溶液混合发生反应的离子方程式___________________________;
小军在实验室里做了下列实验:
①分别向盛有稀硫酸和稀盐酸的试管中,滴加紫色石蕊试液;②向盛有稀硫酸的试管中,滴加氢氧化钠试液;③向盛有锌粒的试营中,分别滴加稀盐酸和稀硫酸;④将一根生锈的铁钉分别放入盛有稀盐酸和稀硫酸的试管中,过一会儿取出。
他在纸上记录了以下现象:
a. 溶液没有明显现象;b. 溶液变为黄色;c. 溶液显红色;d. 产生气泡,溶液无色。
下面请你来整理完成实验报告。
(1)实验目的:探究__________(填写物质类别)的化学性质。
(2)实验现象:产生a现象的实验所对应的一类反应通常被我们称作__________反应(该反应属于复分解反应)。
(3)上题所涉及的这类反应在日常生活和工农业生产中有广泛的应用。请举出一个利用该反应的实例:______________________________。
有一无色溶液,可能含有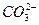 、
、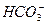 、Cl-中的一种或几种,向其中滴加过量的BaCl2溶液,未见明显现象;又向混合溶液中滴加NaOH溶液时,溶液中产生了白色沉淀;再向固液混合物中滴加足量稀盐酸时,白色沉淀溶解,溶液中逸出无色、无味的气体,将该气体导入澄清的石灰水后,石灰水中产生了白色沉淀。原无色溶液中肯定存在的离子是什么?若向原无色溶液中直接滴加稀盐酸时,有何现象?
、Cl-中的一种或几种,向其中滴加过量的BaCl2溶液,未见明显现象;又向混合溶液中滴加NaOH溶液时,溶液中产生了白色沉淀;再向固液混合物中滴加足量稀盐酸时,白色沉淀溶解,溶液中逸出无色、无味的气体,将该气体导入澄清的石灰水后,石灰水中产生了白色沉淀。原无色溶液中肯定存在的离子是什么?若向原无色溶液中直接滴加稀盐酸时,有何现象?
红矾钠(重铬酸钠:Na2Cr2O2·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中用作氧化剂,应用十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)作原料利用以下过程来制取。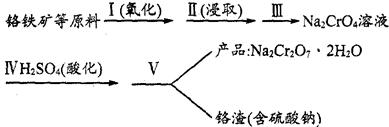
①步骤I中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
| A.升高温度 | B.将原料粉碎 | C.增加纯碱的用量 | D.通入过量的空气 |
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外,还含有铝、硅元素的化合物,它们的化学式可能是__________。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是_________________________________。
④步骤Ⅳ中发生反应的离子方程式为______________________________________________。
(2)将红矾钠与KCl固体按1:2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程
| 序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
| ① |
溶解 |
将混合物放入烧杯中、加水、充分搅拌直到固体不能溶解 |
| ② |
||
| ③ |
||
| ④ |
||
| ⑤ |
过滤、干燥 |
得到K2Cr2O7晶体 |