海水中蕴藏着丰富的资源。海水综合利用的部分流程图如下: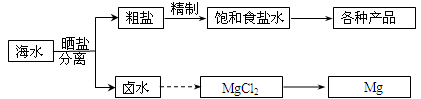
回答下列问题:
(1)用NaCl做原料可以得到多种产品
①工业上由NaCl制备金属钠的化学方程式是 。
②实验室用惰性电极电解200mLNaCl溶液,若阴阳两极均得到224mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84”消毒液。“84”消毒液的有效成分为 ,制取它的化学方程式为 。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O;
d.将MgCl2•6H2O在一定条件下可以得到无水MgCl2;
e.电解熔融的MgCl2可得到Mg。
①上述提取镁的流程c中,得到MgCl2溶液的离子方程式为 。
②步骤d中的“一定条件”指的是 。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗? (填“同意”或“不同意”),请说出你同意或不同意的理由 。
12.4 g Na2X中含Na+ 0.4 mol,则Na2X的摩尔质量是____________________,X的相对原子质量是_______________。
下列各组物质的分离或提纯,应选用下述方法的哪一种?(填序号)
| A.分液 | B.过滤 | C.萃取 | D.蒸馏 E、结晶 F、加热分解 |
(1)除去Ca(OH)2溶液中悬浮的 CaCO3;
(2)除去 KCl 中少量 KClO3。
(3)用自来水制取蒸馏水;
(4)分离植物油和水;
(5)除去 NaCl 中所含的少量 KClO3;
(1)用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制100mL1.84mol·L-1的稀硫酸,若实验仪器有:A.100mL量筒;B.托盘天平;C.玻璃棒;D.50mL容量瓶;E.10mL量筒,F.胶头滴管;G.50mL烧杯;H.100mL容量瓶,实验时应选用仪器的先后顺序是(填入编号):_______________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填编号)________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2~3cm处,用滴管加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后,直接倒入容量瓶中,缓慢加入蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
F.往容量瓶中转移溶液时应用玻璃棒引流
将3.22g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为g。
M(NO3)2热分解化学方程式为2M(NO3)2==2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是_________。