二甲醚具有优良的燃烧性能,被称为21世纪的“清洁能源”,以下为其中一种合成二甲醚的方法:在一定温度、压强和催化剂作用下,在同一反应器中进行如下反应:
①CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g) +H2O(g) △H1=-49.1 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+ 41.2 kJ·mol-1
CO(g)+H2O(g) △H3=+ 41.2 kJ·mol-1
(1)写出CO2(g)加H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式是 。
(2)一定条件下,原料气中n(H2)/n(CO2)比值和温度对CO2转化率影响的实验数据如下图。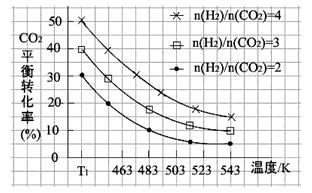
①温度为T1 K时,在1 L反应容器中投入2mol CO2 和8mol H2进行反应,试计算达到平衡时CO2的浓度为 。
②结合数据图,归纳CO2平衡转化率受外界条件影响的变化规律:
a 。
b 。
(3)为研究初始投料比与二甲醚产率关系,在一定温度和压强下,投入一定物质的量的H2、CO、CO2进行试验,实验发现二甲醚的平衡产率随原料气中n(CO)/〔n(CO)+n(CO2)〕比值增大而增大,试分析其原因 。
(4)下图是科学家现正研发的,以实现反应①在常温常压下进行的装置。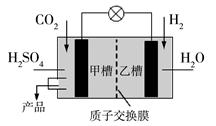
写出甲槽的电极反应 。
液晶高分子材料应用广泛。新型液晶基元——化合物Ⅳ的合成线路如下:
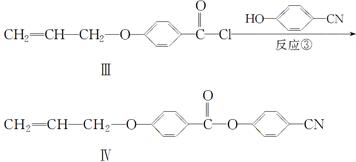
(1)化合物Ⅰ的分子式为________,1 mol化合物Ⅰ最多可与________mol NaOH反应。
(2)CH2===CH—CH2Br与NaOH水溶液反应的化学方程式为____(注明条件)。
(3)化合物Ⅰ的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中一种同分异体的结构简式____________________。
(4)下列关于化合物Ⅱ的说法正确的是_______(填字母)。
| A.属于烯烃 |
| B.能与FeCl3溶液反应显紫色 |
| C.一定条件下能发生加聚反应 |
| D.能使溴的四氯化碳溶液褪色 |
(5)反应③的反应类型是________。在一定条件下,化合物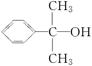 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
)已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为
_________________________________________________________________
________________________________________________________________。
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为________________________________________________________________。
(4)已知下列几种试剂:
a.无水CuSO4 b.品红溶液 c.酸性KMnO4溶液
d.澄清石灰水 e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adeb C.abcbd D.abd
氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件)___________________________________________________________。
(2)实验室中还可以采用如图1装置(略去了夹持装置)和药品快速制备氨气:
①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是________(填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气________个烧瓶。
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图2,装置B中盛装的干燥剂是________。
②该同学利用图3装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法:__________________________________________________
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
对实验现象的“解释或结论”正确的是 ( )。
| 选项 |
实验现象 |
解释或结论 |
| A |
a处变蓝,b处变 红棕色 |
氧化性:Cl2>Br2>I2 |
| B |
c处先变红,后褪色 |
氯气与水生成了酸性物质 |
| C |
d处立即褪色 |
氯气与水生成了漂白性物质 |
| D |
e处变红色 |
还原性:Fe2+>Cl- |
明矾石的主要成分为K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质。某校研究小组利用明矾石制备氢氧化铝的流程如下: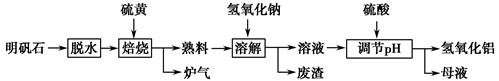
(1)“焙烧”过程中反应的化学方程式为 Al2(SO4)3+
Al2(SO4)3+ S
S
 Al2O3+
Al2O3+ ________↑。
________↑。
(2)分离溶液和废渣的操作是________,“溶解”时反应的离子方程式为_________________________________。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是________。
(4)“母液”中可回收的物质是________。
(5)若“焙烧”过程中恰好消耗48 g硫黄,则理论上最终可得到________ g氢氧化铝。