(15分)下表为元素周期表中的前四周期元素,列出了10种元素在元素周期表中的位置。试用元素符号、离子符号或化学式回答下列问题。
(1)元素⑦可形成18电子的氢化物X其电子式为 ,⑥与⑨形成的5原子分子的结构式为 。
(2)①②③④⑤五种元素最高价氧化物对应水化物中,碱性最强的是 (填化学式),该物质内部含有的化学键类型是 。
(3)④形成的简单离子的结构示意图 。
(4)第五周期元素中,与⑨元素同主族的元素原子序数为 ,用一个离子方程式比较该元素与⑨元素的非金属性强弱 。
(5)⑦的氢化物比⑧的氢化物的熔沸点高的原因是___ __
(6)⑤的单质与①的最高价氧化物对应的水化物反应的离子方程式为 。
(16分)
(1)实验室少量的金属钠保存在中,取用时用到的仪器和用品有, 剩余的钠应;将一小块钠投入到硫酸铜溶液中,反应的离子方程式为,观察到的现象为(填写标号)。
a.钠浮在液面上四处游动b.钠融成了一个闪亮的小球
c.溶液中有蓝色沉淀生成 d.溶液中有红色固体析出
(2)实验室制氯气的化学反应方程式为_________________________________;氯气为有毒气体,需用氢氧化钠溶液进行尾气处理,请完成该离子方程式, 该原理还可用于工业制。
(3)下列物质既能与酸反应,又能与碱反应的是
a. Al b. Mg c. CH3COONH4 d. NaHCO3 e. Al2O3
科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原理为: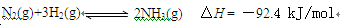
该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,E2的变化是:。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应: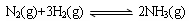
5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)=,H2的转化率为,该反应在此温度下的化学平衡常数为。(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是。
| A.向容器中按原比例再充入原料气 |
| B.向容器中再充入惰性气体 |
| C.改变反应的催化剂 |
| D.液化生成物分离出氨 |
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为。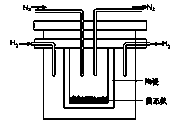
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应: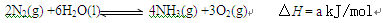
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
此合成反应的a0。(填“大于”、“小于”或“等于”)
现有浓度均为0.1 mol/L的下列溶液:①硫酸②醋酸③氢氧化钠④氯化铵⑤硫酸铝⑥碳酸氢钠。请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)。
(2)已知T℃,Kw = 1×10-13,则T℃25℃(填“>”、“<”、“=”);在T℃时,将pH=11的③溶液a L与pH = 2的①溶液b L混合(忽略混合后溶液体积的变化),若所得溶液的pH = 10,则a:b = 。
(3)将⑤溶液和⑥溶液混合时,可看到的实验现象是,产生该现象的原因是(用离子方程式解释原因)。
25℃时,50mL 0.10mol/L的醋酸中存在着如下平衡:
CH3COOH  CH3COO―+H+
CH3COO―+H+
加入少量冰醋酸,平衡将______(填“向右移动”、“向左移动”或“不移动”),溶液中C(H+)将_______(填“增大”、“减小”或“不变”),醋酸的电离程度将__________(填“增大”、“减小”或“不变”)。
(4分) 某烷烃的结构简式为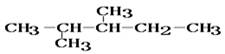
(1)用系统命名法命名该烃:________________________________.
(2)若该烷烃是由烯烃加氢得到的,则原烯烃的结构有_____种.(不包括立体异构,下同)
(3) 若该烷烃是由炔烃加氢得到的,则原炔烃的结构有_____种.
(4) 该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有____种.