高纯硅是信息产业最基础的原材料,制备高纯硅的主要生产过程如下:
【资料】①石英砂的主要成分是SiO2 ②生产过程中涉及到的反应均为置换反应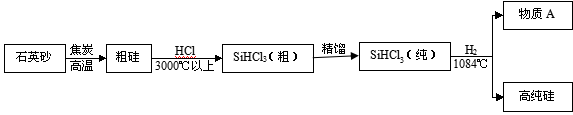
(1)SiO2中Si的化合价是____________。
(2)从SiHCl3(纯)得到高纯硅的化学方程式是_________________________________。
(3)生产过程中可循环使用的物质是____________。
右图是化学中“著名”的多用途装置,有如下用途: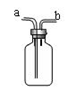
(1)可以用做向上排空气法收集氧气,从______端进氧气。
(2)可以用做排水法收集氧气,在集气瓶中装满水,从______端进氧气。
(3)医院里给病人输氧为了给氧气加湿和观察氧气的输出速度也可以在氧气瓶和病人之间连接该装置,在集气瓶装半瓶水,将______端接氧气钢瓶,通过观察_____________就知道氧气的输出速度。
右图表示了化合反应和氧化反应的关系。按示例填空:
A部分:是化合反应,不是氧化反应,例:二氧化碳+水→碳酸;
B部分: ,例: ;
C部分: ,例: 。
装满氧气的甲、乙两个集气瓶(甲瓶口向上,乙瓶口向下),用带火星的木条分别由瓶口迅速伸入瓶底,发现木条复燃,且在甲瓶中比在乙瓶中燃烧旺且时间长。上述实验说明了氧气具有的性质是:
(1)__________________________;(2)___________________________。
下图是实验室常见的制取气体的装置: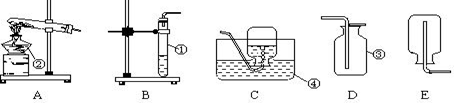
(1)写出仪器名称:①________②________③________④________。
(2)实验室采用装置A制取氧气时,其试管中应放的药品是,试管口还要放一团棉花,目的是,该反应的符号表达式是________________________。
(3)采用装置B制取氧气时,其试管中应放的药品是,所发生反应的符号表达式是;
(4)收集氧气可以选择装置或,原因是、_。
(5)某同学收集完毕,先停止加热再将导管移出水面,你预测这种操作会引起什么后果?____________________________________________。
甲、乙、丙是三个实验的示意图,根据下图中所发生的化学反应,进行总结归纳并回答下列问题:
(1)所发生的三个反应有多个共同的特点,分别是:
①,②,
③,④……(只答四点即可)。
(2)它们也有许多不同,请指出其中一个与另外两个的不同之处:。