课外小组同学进一步研究铁与氧气的反应。
【提出问题】铁丝燃烧时为什么会有“火星四射”的现象?
【查阅资料】铁丝燃烧时“火星四射”现象与铁丝含碳量有关。
【进行实验】探究铁丝在氧气燃烧时“火星四射”的现象与其含碳量的关系。
| 实验 |
现象 |
解释与结论 |
| 实验1:取直径0.20 mm,含碳0.1%的铁丝,在氧气中燃烧 |
零星的火星四射 |
①铁燃烧的化学方程式是 ________________________ ②0.20 mm的铁丝在氧气中燃烧,“火星四射”与其含碳量的关系为________________________ |
| 实验2:取直径0.20 mm,含碳0.32%的铁丝,在氧气中燃烧 |
较明显的火星四射 |
|
| 实验3:取直径0.20 mm,含碳0.52%的铁丝,在氧气中燃烧 |
________________________ |
【提出问题】纯铁在氧气中燃烧溅落的“黑色固体”是什么?
【查阅资料】
①自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO易被氧化)
②铁的氧化物均能溶于酸溶液
【进行实验】测定黑色固体的成分。
| 实验 |
现象及数据 |
解释与结论 |
| 实验4:将冷却后的黑色固体碾碎,装入试管,加入____________溶液 |
现象是______________________ |
铁燃烧时溅落下来的黑色固体中含有铁 |
| 实验5:取2.8 g纯铁在氧气中燃烧,收集溅落的黑色固体,干燥并称其质量 |
黑色固体质量为3.44 g |
黑色固体的组成及质量为 ______________________ |
【实验拓展】
同学们认为铁丝燃烧的现象还与氧气的浓度有关,所以想收集不同浓度的氧气进行相关实验。若用排水集气法收集一瓶体积分数约为80%的氧气,预先应向容积为360 mL的集气瓶中加水,水的体积为______mL。
某研究型学习小组的同学在用浓硫酸处理废锌片时发现产生的气体具有刺激性气味,这种现象引起同学们的思考和研究。
【提出猜想】对产生的气体进行猜想:
猜想1:可能是H2;
猜想2:可能是SO2;
猜想3:可能是
【查阅资料】SO2易溶于水,能与NaOH溶液反应生成Na2SO3。
【实验方案】研究性学习小组的同学设计如图所示的装置进行研究(夹持仪器已省略,假设装置中的反应都进行完全)。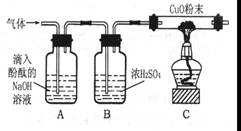
【问题讨论】
(1)如果装置A中没有明显现象,装置C中的现象为则猜想成立。
(2)如果装置A中的现象为,装置C中没有明显的现象则猜想成立。
(3)猜想3成立的实验现象是
。
(4)装置B中浓硫酸的作用是。
【思维拓展】
实验室中可以用氢氧化钠溶液吸收二氧化硫,反应的化学方程式是
。
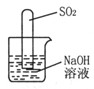
(2)小组内一同学又设计了判断SO2与NaOH溶液能否反应的装置(如图),实验时发现试管内液面上升,就得出SO2与NaOH溶液反应的结论,其同学认为这一结论不严谨,理由是。要得到科学严谨的结论,仍利用该装置,需做的对比实验是
。
(1)实验室给你提供了下列仪器,请选用合适的仪器完成指定的实验。

①要制取较多的O2用来探究其性质(要求制取过程中可以添加反应物),组装气体发生装置需要的仪器是___ ___(填序号),收集氧气应采取___ _____法。
②提纯粗盐时,过滤需要选用上述仪器中的_____ ____(填序号),除此之外还缺少的仪器是____ _____、____ ______(填名称)。
(2)美羊羊同学在购买回的袋装薯片中发现还有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色的,大多数是灰白色的。经过分析,她认为棕红色粉末是Fe2O3,灰白色粉末应该含有CaCO3和Fe,为验证自己的判断,美羊羊同学打算进行实验探究,请你一同参与。
【实验目的】证实灰白色粉末中含有CaCO3和Fe。
【实验设计】装置如下图所示:

【实验预测与分析】
①若要证实样品中含有CaCO3,观察到的实验现象是_______ ____________,B中发生反应的化学方程式为___ _____。
②若要证实样品中含有Fe,E中应观察到的现象是____ _________,此时C装置的作用是____ ____________。
③看了美羊羊同学的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式__________。
通过学习碱的性质,我校化学兴趣小组的同学对实验室的“氢氧化钙是否变质以及变持的程度”展开了探究活动,请你一同参与:
⑴提出问题:氢氧化钙是否变质?
⑵猜想与假设:同学们经过讨论认为样品存在三种可能情况:没有变质;部分变质;完全变质。
⑶实验探究:
| 实验步骤及操作 |
实验现象 |
实验结论 |
| 取样于试管中,加入足量蒸馏水振荡,静置 ①取上层清液,滴入无色酚酞试液 ②倒去上层清液,再向试管中注入稀盐酸 |
①无色酚酞试液变红 ② |
部分变质 |
| ①无色酚酞试液不变红 ② |
||
| ① ②没有气泡产生 |
⑷小结与思考:
①小蔓同学根据上述实验方案进行实验,确定该样品已部分变质,请写出实验中反应的化学方程式:
②氢氧化钙俗称熟石灰,农业上常用来。
某兴趣小组的同学们以“稀硫酸与氢氧化钠溶液能否发生反应”为课题进行了科学探究。
同学们在烧杯中加入10mL稀硫酸。滴入几滴酚酞试液,接着分两次向烧杯中滴入氢氧化钠溶液。第一次滴加几滴氢氧化钠溶液后,不断搅拌,第二次继续滴加氢氧化钠溶液至过量。则第一次滴加氢氧化钠溶液时,溶液中溶质(不考虑酚酞)的质量变化情况是__________:第二次滴加氢氧化钠溶液时观察到的现象是_______________________。
由上述实验同学们得出了稀硫酸与氢氧化钠溶液能发生反应的结论。
[提出问题]是否可以用其他试剂证明稀硫酸与氢氧化钠溶液能发生反应呢?
[甲组实验]实验过程如图所示:
现象:向a试管中滴加氢氧化钠溶液时无明显现象,再滴加几滴硫酸铜溶液时出现蓝色沉淀。
结论:用硫酸铜溶液可以证明稀硫酸与氢氧化钠溶液能发生反应。
[乙组实验]实验过程如图所示:
现象:向b试管中滴加氢氧化钠溶液时无明显现象,再滴加几滴氯化钡溶液时出现白色沉淀。
结论:用氯化钡溶液可以证明稀硫酸与氢氧化钠溶液能发生反应。
[交流评价]请你评价甲、乙两组同学由实验现象获得的结论是否正确,并说明理由。
| 正确或错误 |
理由 |
|
| 甲组 |
||
| 乙组 |
(10,娄底29)小林觉得你很聪明,是他的良师益友,学完“酸的化学性质”后,邀请你与他讨论“食醋在厨房中的妙用”:
(1)复习酸的化学性质
| ①酸与指示剂作用 |
酸溶液能使紫色石蕊溶液变红色 |
酸溶液不能使无色酚酞溶液变色 |
| ②酸与活泼金属作用 |
Fe+2HCl=FeCl2+H2↑ |
Fe+H2SO4=FeSO4+H2↑ |
| ③酸与某些金属氧化物作用 |
Fe2O3+HCl=FeCl3+H2O |
…… |
| ④…… |
由于小林的课堂笔记没做好,“③酸与某些金属氧化物作用”后面的化学方程式未配平,请帮他写出配平后的化学方程式: 63。
(2)讨论交流
① 小林自豪地说,目前世界卫生组织正在推广使用中国铁锅,使用铁锅炒菜时,放点食醋时,可以补充人体需要的微量元素 64元素,该反应的原理是利用了酸的化学性质 65(填序号“①”、“②”或“③”)。
② 你告诉小林,食醋的作用远远不止这些呢,如 66(任写一点食醋在生活中的妙用)。
(3)反思
盐酸、硫酸、食醋具有相似化学性质的原因是因为它们的水溶液中都含有 67离子。