(1)实验室给你提供了下列仪器,请选用合适的仪器完成指定的实验。

①要制取较多的O2用来探究其性质(要求制取过程中可以添加反应物),组装气体发生装置需要的仪器是___ ___(填序号),收集氧气应采取___ _____法。
②提纯粗盐时,过滤需要选用上述仪器中的_____ ____(填序号),除此之外还缺少的仪器是____ _____、____ ______(填名称)。
(2)美羊羊同学在购买回的袋装薯片中发现还有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色的,大多数是灰白色的。经过分析,她认为棕红色粉末是Fe2O3,灰白色粉末应该含有CaCO3和Fe,为验证自己的判断,美羊羊同学打算进行实验探究,请你一同参与。
【实验目的】证实灰白色粉末中含有CaCO3和Fe。
【实验设计】装置如下图所示:

【实验预测与分析】
①若要证实样品中含有CaCO3,观察到的实验现象是_______ ____________,B中发生反应的化学方程式为___ _____。
②若要证实样品中含有Fe,E中应观察到的现象是____ _________,此时C装置的作用是____ ____________。
③看了美羊羊同学的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式__________。
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是______________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】(1)金属氧化物能和酸反应且生成物能溶于水(2)信息如表格
| 常见铁的氧化物 |
FeO |
Fe2O3 |
Fe3O4 |
| 颜色、状态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
| 能否被磁铁吸引 |
否 |
否 |
能 |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。
【实验探究】
| 实验操作 |
实验现象 |
结论 |
| 猜想二正确 |
【实验结论】铁和水蒸气反应的化学方程式为___________________________________.
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________.
科学探究常用控制实验条件(控制变量)进行对比实验的方法。如关于燃烧条件的探究有:可燃物、助燃物、着火点(温度)三个控制变量。
(1)某同学在探究燃烧条件的时候做了如下实验:
①把石块和木条同时放在酒精灯火焰上,这是把可燃物作为控制变量的一个对比实验,实验的结果是________________________。
②两支燃着的蜡烛分别放在两个集气瓶内,然后用玻璃片盖住其中一个集气瓶的瓶口,结果发现盖上玻璃片的集气瓶里面的蜡烛很快就熄灭了,而没有盖上玻璃片的集气瓶里的蜡烛没有熄灭。实验的结果证明____________,这个实验是把___________________作为控制变量进行的对比实验。
(2)实验证明,白磷和红磷都是可燃物。右图利用白磷和红磷进行燃烧条件的探究实验中,也运用了两个对比实验的方法。
①铜片上的白磷和红磷是把_________________作为控制变量的一个对比实验,实验的现象是_________________________,实验的结果证明__________________________。
②铜片上的白磷和水中的白磷是把____________作为控制变量的一个对比实验,实验的现象是________________________________________.
用来测定空气成分的方法很多,图1所示的是小明用红磷在空气中燃烧的测定方法。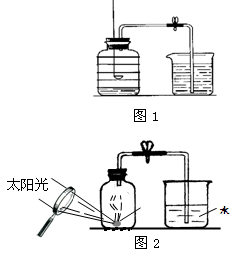
实验过程是:
第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入极其瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5。
请回答下列问题:
(1)上面的实验同时证明了氮气有 的化学性质。
(2)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能。
(3)某同学对实验进行反思后,提出了改进方法(如图2所示),你认为改进后的优点是:。
大明和小明发现市场上有些食品装在充满气体的塑料袋内,显得鼓鼓的。经询问得知:这样充气的包装,主要是为了使食品能较长时间保鲜、保质和不易压碎。那么,这是什么气体呢?大明猜想是二氧化碳,小明猜想是氧气。
(1)假设大明的猜想正确,请你用实验方法证明(要求写出操作步骤和实验现象)
(2)假设小明的猜想正确,请你用实验方法证明(要求写出操作步骤和实验现象)
(3)你认为食品充气包装中,对所充气体的要求是(写出两点):
① ,② 。
(4)根据⑶中要求,你认为(填"大明"或"小明")的猜想正确。
某同学为了研究竹子里面气体的成分,做了一个实验。
(1)他先将竹子浸在水里,钻个小孔,看到一串串气泡冒出。然后采用法(填实验室常用的一种集气方法)收集到了甲乙两瓶气体。
(2)将放有足量红磷的燃烧匙伸入甲瓶中(如图)。用放大镜聚焦,使红磷燃烧,瓶内充满了白烟。然后,将甲瓶倒放水中,松开夹子,结果流入的水约占瓶子容积的1/10。这说明竹子里的气体中肯定含有。
(3)再往乙瓶中倒入一些澄清石灰水,发现石灰水马上变浑浊。这说明竹子里的气体中肯定含有。
(4)那么竹子里的气体含量与空气有什么区别呢?于是,他又用空气重复了上述实验。相比较后得出的结论是:。