某同学为了研究竹子里面气体的成分,做了一个实验。
(1)他先将竹子浸在水里,钻个小孔,看到一串串气泡冒出。然后采用 法(填实验室常用的一种集气方法)收集到了甲乙两瓶气体。
(2)将放有足量红磷的燃烧匙伸入甲瓶中(如图)。用放大镜聚焦,使红磷燃烧,瓶内充满了白烟。然后,将甲瓶倒放水中,松开夹子,结果流入的水约占瓶子容积的1/10。这说明竹子里的气体中肯定含有 。
(3)再往乙瓶中倒入一些澄清石灰水,发现石灰水马上变浑浊。这说明竹子里的气体中肯定含有 。
(4)那么竹子里的气体含量与空气有什么区别呢?于是,他又用空气重复了上述实验。相比较后得出的结论是: 。
(共7分)在化学兴趣小组活动中,小华把一标有“生石灰干燥剂”的小纸袋带到学校进行实验。干燥剂是否变质?小华与小冬设计并进行了如下实验,请你帮他们完成实验报告。
(1)小华设计实验步骤是:取少量干燥剂放入试管中,加入少量,观察到的实验现象是:,得出结论是:干燥剂中含有CaO;
小冬设计实验步骤是:取少量干燥剂制得的溶液于试管中,滴入几滴酚酞试液,观察到的实验现象是:,得出结论是干燥剂中含有Ca(OH)2。
(2)小明认为小冬的实验不科学,理由是_______________________________。
(3)既然干燥剂中已有Ca(OH)2,小华又猜想还可能有另一种物质生成,原因是_______________(用化学方程式表示)。请你设计实验证明小华的猜想(简要写出实验步骤、现象及结论)_____________。
小明用下图A所示装置测定空气中氧气的含量.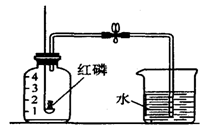
(1)实验时,取下橡胶塞,点燃红磷后迅速伸入集气瓶中并旋紧橡胶塞,这时看到的现象是_________,该反应的符号表达式为_______ _____.
(2)小明又设计了如下图所示的改进装置, 其中A是底面积为50 cm3、高20cm的圆筒状玻璃容器(带密封盖),上面标有以cm为单位的刻度.B是带刻度的敞口玻璃管(其他辅助装置略)。他们的操作过程如下:
a.检查装置的气密性;
b.加入水并调整B的高度.使A中的液面至刻度15 cm处;
c.将过量的红磷平铺在惰性电热板上。盖紧密封盖;
d.通电加热红磷,待充分反应后.冷却到原来的状况,调整B的高度使容器A、B中的液面保持水平,记录液面刻度。(注:A容器内固态物质所占的体积忽略不计)
①在操作a中检查装置气密性的方法是。
②在操作d结束时,装置A 中液面的刻度约为cm(填整数)。如果在操作d结束时,装置A中液面刻度在11cm处.则实验结果比理论值(填“偏大”或“偏小”)。
③改进后的装置的优点是______________.
化学是一门实验科学。我们可以通过观察肉眼可见的实验现象,再加上分析推理,来认识分子的性质和确认分子的真实存在。
【实验理解】
(1)用如图所示的装置进行实验:在大烧杯罩住的两个小烧杯中,分别盛有。
A.浓氨水和酚酞溶液
B.酚酞溶液和酚酞溶液
C.浓氨水和浓氨水
(2)本实验用到对照的方法,起对照作用的是不变色和变色。
(3)实验中可以直接观察到的项目是
A.氨分子的质量和体积都很小
B.氨分子在不断运动
C.氨分子之间有间隔
D.A烧杯和B烧杯内的溶液都变红
E.A烧杯内的溶液变红
【实验延伸】
某同学对浓氨水使酚酞溶液变红的速度发生了浓厚的兴趣,并设计了以下探究实验:
①制备“标准色”溶液:取浓度为20%的5mL浓氨水、20mL酚酞溶液注入小烧杯,并给小烧杯蒙上塑料薄膜。
②另取适量药品用一只大烧杯和两只小烧杯仿照上图进行实验,观察并测定酚酞溶液变成“标准色”所需的时间。
【问题探究】
(4)给“标准色”溶液的小烧杯蒙上薄膜的作用是。
(5)想尽快使酚酞溶液变成“标准色”的方法有多种,一种方法是,还有一种方法是。
某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是。
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究。
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出【实验探究】(2)中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
(1)实验操作中的错误是。
(2)实验方案中也有一个是错误的,错误的原因是。
有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化: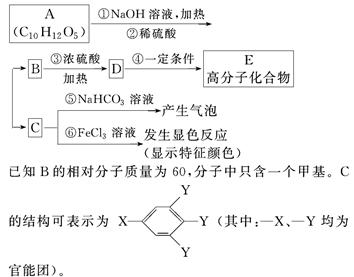
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为XYYY(其中:—X、—Y均为官能团)。
请回答下列问题:
(1)根据系统命名法,B的名称为____________。
(2)官能团—X的名称为____________,高聚物E的链节为____________________________________。
(3)A的结构简式为_____________________。
(4)反应⑤的化学方程式为_________________。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式______________。
Ⅰ.含有苯环
Ⅱ.能发生银镜反应
Ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是________(填序号)。
a.含有苯环 b.含有羰基 c.含有酚羟基