有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化: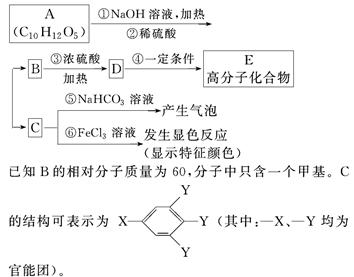
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为XYYY(其中:—X、—Y均为官能团)。
请回答下列问题:
(1)根据系统命名法,B的名称为____________。
(2)官能团—X的名称为____________,高聚物E的链节为____________________________________。
(3)A的结构简式为_____________________。
(4)反应⑤的化学方程式为_________________。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式______________。
Ⅰ.含有苯环
Ⅱ.能发生银镜反应
Ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是________(填序号)。
a.含有苯环 b.含有羰基 c.含有酚羟基
无土栽培是利用营养液栽培作物的一种方法.
(1)下列化学肥料中属于复合肥的是________(填序号).
①硝酸铵
②磷酸二氢铵
③硝酸钾
④硫酸钾
(2)某同学要在实验室配制150g溶质质量分数为2%的硝酸钾溶液,需要硝酸钾的质量为________g.
(3)现有一种无色的营养液,可能由KNO3、Ca(NO3)2、K2CO3、KCl中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验.
根据以上实验,请你进行有关推断.
①由实验1可确定原营养液中一定没有的物质是________________;
②根据实验1、实验2推测原营养液的组成可能有________种情况;
③若测得原营养液中K+和Cl-的数目之比为1︰1,则原营养液的组成中的溶质是________
________________________________________________________________________.
反思、归纳与提升是化学学习的重要方法.
对于复分解反应及其规律,通过反恩与探索,同学们有了新的认识.请填写下文中横线上的空白.
[知识回顾]
(1)氯化氢气体、氢氧化钠固体不导电.
(2)盐酸、氢氧化钠溶液能导电.
[分析归纳]
氯化氢溶于水:HCl H++Cl-
H++Cl-
氢氧化钠溶于水:NaOH Na++OH-
Na++OH-
结论:溶液导电是由于溶液中存在自由移动的离子.
[迁移运用]硫酸钠溶液能导电,原因是硫酸钠溶于水:Na2SO4 ________.
________.
[探索发现]
(1)氢氧化钠溶液与盐酸反应的微观示意图
[分析归纳]
反应的化学方程式:________________________.
反应的实质:H++OH- H2O,反应能进行的原因是溶液中H+和OH-的数目减少,即自由移动的离子数目减少.
H2O,反应能进行的原因是溶液中H+和OH-的数目减少,即自由移动的离子数目减少.
(2)硫酸钠溶液跟氯化钡溶液反应的微观示意图: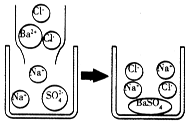
[分析归纳]
反应的化学方程式:________________________.
反应的实质:略.
反应能进行的原因是溶液中________________________的数目减少,即自由移动的离子数目减少.
(提示:该反应有硫酸钡白色沉淀生成)
(3)有气体生成的复分解反应,以Na2CO3+2HCl=2NaCl+H2O+CO2↑为例,反应实质:2H++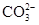
 ________.
________.
[总结规律]
上述复分解反应能发生的本质原因是________________________________________
________________________________________________________________________.
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小滨同学设计了实验,以探究碳酸氢钠的化学性质.
[探究实验1]碳酸氢钠溶液的酸碱性
[实验方案1]取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞溶液,振荡.
现象:溶液变成浅红色.由此得出结论________________________________________
________________________________________________________________________.
[探究实验2]能与酸反应
[实验方案2]取少量该固体加入试管中,滴加稀盐酸,现象为________________________________.
[探究实验3]碳酸氢钠的热稳定性
[实验方案3]用下图所示装置进行实验
现象:充分加热后,大试管口有水珠出现,管底有白色固体残留,小试管中澄清石灰水变浑浊.
结论:碳酸氢钠受热能生成二氧化碳、水和一种白色固体.
验证:(1)请你帮小滨设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH(所选试剂不能用酸).
步骤:________________________________________________________________________.
现象:________________________________________________________________________.
(2)碳酸氢钠受热分解的化学方程式________.
[拓展应用]试说出碳酸氢钠在日常生活中的一种用途________________________________.
某校兴趣小组对氢氧化钠溶液与稀盐酸混合后的有关问题,进行了如下探究,请同学们一起参与此次探究之旅.
(1)探究一:判断氢氧化钠溶液与稀盐酸混合后是否恰好完全中和?
[方案设计]小亮、小丽、小林三位同学设计了如下方案进行探究:
| 方案设计者 |
方案步骤 |
方案预估现象 |
方案预估结论 |
| 小亮 |
取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞溶液,振荡 |
酚酞溶液不变色 |
恰好完全中和 |
| 小丽 |
用一根洁净的玻璃棒蘸取反应后的溶液沾在pH试纸上,把试纸呈现的颜色与标准比色卡对照 |
pH=7 |
恰好完全中和 |
| 小林 |
取少量反应后的溶液于一支试管中,并向试管中滴加稀硝酸和硝酸银溶液 |
有白色沉淀生成 |
盐酸过量,没有完全中和 |
[方案评价]请判断以上设计的三个方案中,____①____同学的方案是正确的.
[方案反思]请分析另外两个方案错误的原因:____②____;____③____.
(2)探究二:氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分是什么?
[作出猜想]小亮猜想:溶质有NaCl、HCl、NaOH;
小丽猜想:溶质只有NaCl;
小林猜想:溶质有NaCl、HCl;
你的猜想:溶质有____①____(填化学式).
小丽认为小亮的猜想是错误是,她的理由是____②____.
[实验设计及验证]请你将下列报告填写完整:
| 实验操作 |
实验现象 |
实验结论 |
| 取反应后的溶液于试管中,加入碳 酸钠溶液 |
③ |
小林猜想正确 |
| ④ |
有蓝色沉淀生成 |
你的猜想正确 |
王奇在学习了碱的化学性质后,了解到碱溶液可使无色酚酞溶液变红色.王奇很善于动脑,他想动手探究氢氧化钠溶液(含H2O、Na+、OH-)中哪一种粒子可使酚酞变红色.请你一起来探究:
实验步骤:
(1)在第一支试管中加入约2mL蒸馏水,滴入几滴酚酞溶液,观察现象.
(2)在第二支试管中加入约2mL NaCl溶液,滴入几滴酚酞溶液,观察现象.
(3)在第三支试管中加入约2mL NaOH溶液,滴入几滴酚酞溶液,观察现象.
通过上述实验的探究,回答下列问题(其中“现象”是指无色酚酞溶液是否变红):
实验(1)看到的现象是________________________,你得出的结论是________________________________.
实验(2)看到的现象是________________________________________________________,
说明Na+____________________________________________________________________.
实验(3)看到的现象是________________________________,你得出的结论是________________________________________.