生活中常遇见铜制品生锈的情况。活动课上,同学们设计实验对铜锈进行了如下探究活动。
探究活动一:验证铜锈的组成
【查阅资料】
① 铜锈为绿色,其主要成分是Cu2(OH)2CO3。
② 白色的硫酸铜粉末遇水能变为蓝色。
③ 碳不与稀硫酸反应。
④ 氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液。
【进行实验1】
同学们设计了下图所示装置并进行实验。
| 实验操作 |
实验现象 |
实验结论 |
| ① 按上图组装仪器,装入药品。 ② 加热铜锈,直至不再有气体产生,停止加热。 |
绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊。 |
加热铜锈生成的物质有_____;铜锈由_____元素组成;烧杯中发生反应的化学方程式为______。 |
| ③ 冷却后,向试管中固体加入适量稀硫酸,稍加热。 |
黑色固体溶解,溶液变为蓝色。 |
探究活动二:探究铜生锈的条件
【进行实验2】
同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显。
(9分)某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出。生成的是什么气体呢?同学们决定进行探究。探究前老师提示,该反应生成的气体只有一种,硫酸铜溶液中可能混有硫酸。
【提出猜想】
①生成的气体可能是SO2或O2或H2。
【查阅资料】
①SO2与二氧化碳化学性质相似,如它也能使澄清石灰水变浑浊。
②浓硫酸具有强烈的吸水性,可做气体的干燥剂。
③H2与CO均可以还原金属氧化物。
【方案设计】甲同学设计了如下实验方案,验证猜想的气体。
甲同学认为:若观察到,则气体为SO2。
若观察到,则气体为O2。
【实验探究】
①实验开始时,应先将收集到的气体从a处通入一段时间后,再点燃 C 处酒精灯。
这样操作的目的是。
②实验过程中发现 A 装置中溶液不变浑浊, C 装置中表面含CuO的铜网由黑色变为光亮的红色,试管壁上有水滴生成;
【实验结论】①生成的气体是。
②铁放入该硫酸铜溶液中所发生反应的化学方程式为。
【实验反思】
乙同学认为甲同学的实验方案操作复杂,他只需一盒火柴即可确定该气体成分。你认为乙同学的实验方案是。
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
(1)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是氢气。
(2)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 |
FeO |
Fe2O3 |
Fe3O4 |
| 颜色、状态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
| 能否被磁铁吸引 |
否 |
否 |
能 |
Fe3O4+8HCl= FeCl2+2FeCl3+4H2O
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。
【实验探究】
| 实验操作 |
实验现象及结论 |
【实验结论】铁和水蒸气反应的化学方程式为___________________________________。
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________。
以下是对实验室制取氧气的条件进行的探究。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲同学设计了以下对比实验:①将3.0g氯酸钾与1.0g二氧化锰混合加热;②将χg氯酸钾与1.0g氧化铜均匀混合加热。在相同的温度下,比较两组实验产生氧气的快慢。
①中的化学方程式是:
②中χ的值应为:
(2)乙同学探究了影响过氧化氢分解速度的某种因素,数据如下:
| 编号 |
过氧化氢溶液的质量 |
过氧化氢溶液的浓度 |
二氧化锰的质量 |
相同时间内产生氧气的体积 |
| ① |
50.0g |
1% |
0.1g |
9ml |
| ② |
50.0g |
2% |
0.1g |
16ml |
| ③ |
50.0g |
4% |
0.1g |
31ml |
由上表可得到的结论是,在相同条件下,,过氧化氢分解得越快。
(3)丙同学用如图装置进行影响过氧化氢分解速度某种因素的实验探究,通过比较,也能达到实验目的。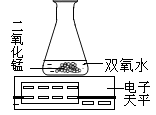
(14分)水在实验室和日常生活中有很多用途。
I、溶液是日常生活中的常见物质,水是最常用的溶剂。
20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:
(1)图1中一定为饱和溶液的是
(2)图3中表示乙的溶解度曲线是;P点表示的含义是。
(3)在图4所示的实验中,小烧杯内盛放的是20℃时甲物质的饱和溶液。某同学要使小烧杯内有固体析出时,他应向大烧杯的水中加入下列物质中的(填字母)。
A.氧化钙B.氯化钠C.氢氧化钠 D.硝酸铵
Ⅱ、水在工业生产中也很重要。
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。电解饱和食盐水可以得到多种化工产品,主要过程如下:
[资料卡:石灰水中的溶质是一种碱——Ca(OH)2]
(4)已知气体A是密度最小的气体,B是一种碱,D是一种酸。写出金属铝和酸D反应生成气体A的化学方程式:。
(5)B的化学式为。
(6)工业上电解食盐水是在立式隔膜电解槽中进行,产生的Cl2和气体A在两处逸出并分别收集、储存。
①已知20℃,S(NaCl)=36g,则室温下,68 kg饱和食盐水中溶质的质量为。
②电解一段时间,当收集到氯气的质量为0.71 kg时,列式计算生成的B的质量。
③0.71 kg氯气和A完全反应生成气体C,溶于一定量的水中形成酸D。若酸D中的溶质质量分数为36.5%,则其中水的质量为。
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究。
【提出问题】金属与盐酸反应的剧烈程度受哪些因素的影响?
【做出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用的金属均已用砂纸打磨。
实验(1)为探究猜想a,小明同学分别在两支试管中放入相同质量的镁片和铁片,然后分别加入相同浓度和质量的稀盐酸,观察到放镁片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,写出镁与盐酸反应的化学方程式。
从实验现象可以判断:金属活动性Mg Fe(填“>”“<”或“=”)。
得出结论:。
实验(2)为探究猜想b,小组同学设计如图装置进行实验,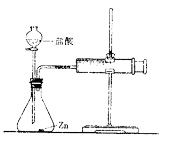
所用药品、实验数据如下表:
| 实验编号 |
选用金属 (均取2g) |
盐酸浓度(均取50ml) |
每30秒产生气体的体积/ml |
|||||
| 30秒 |
30-60 秒 |
60-90秒 |
90-120秒 |
120-150秒 |
前150秒共收集气体 |
|||
| Ⅰ |
镁片 |
10% |
2.9 |
16.9 |
11.9 |
9.2 |
7.6 |
48.5 |
| Ⅱ |
镁片 |
5% |
1.6 |
8.4 |
5.9 |
4.8 |
3.7 |
24.4 |
其中注射器的作用是。
得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是。
【反思评价】本题奖励4分,化学试卷总分不超过60分。
根据表中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因。通过以上探究,你认为金属与盐酸反应的剧烈程度还可能受哪些因素影响,设计实验验证。。