用纯净的木炭粉还原氧化铜粉末时,可能发生如下化学反应:
C + 2CuO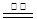 2Cu + CO2↑ C + CuO
2Cu + CO2↑ C + CuO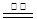 Cu + CO↑
Cu + CO↑
某同学设计一个实验,证明氧化铜中含有氧元素,实验装置如图所示。回答下列问题: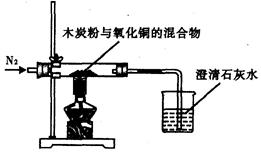
(1)在实验前通入氮气的目的是_________________________________;
(2)本实验能证明氧化铜中含有氧元素的证据是____________________________,写出产生该现象的化学方程式________________________________;
(3)为了使实验成功,反应物要研细混匀,而且木炭粉与氧化铜的质量比为________(填字母)效果较好。选择该质量比的理由是____________________________________。
A.3∶20 B.1∶12
(4)你认为本实验设计中的不足之处是___________________________________。
依据下图所示实验,按要求回答。 
(1)仪器a的名称是_____。A装置中反应的化学方程式是_____。用带火星的木条检验a中的气体,观察到木条着火,则该气体是_____。
(2)装置B可制取氧气,用高锰酸钾制氧气的化学方程式是_____。当气体收集满后,从水槽中取出集气瓶的正确操作顺序是_____(填序号,下同)。
① 将导气管移出集气瓶口② 将集气瓶和玻璃片一起移出水面
③ 在水面下用玻璃片盖住集气瓶口④ 将集气瓶正放在桌面上
(3)小华同学用浓盐酸与大理石在C装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红,对这一现象的解释合理的是_____。
① 产生的CO2直接使石蕊变红
② 挥发出的氯化氢气体溶于水,使石蕊试液变红
③ 产生的CO2与H2O反应生成H2CO3,使石蕊试液变红
(7分)小明上网阅读时得知根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量(Ar)的实验。小明很感兴趣,和化学兴趣小组的同学设计了如下探究活动,请结合下图回答问题。
(1)实验室利用氯化铵和氢氧化钙固体之间的复分解反应制取氨气。小明将A与E连接,观察到无色酚酞试液变红,说明氨气显(填“酸性”、“中性”、或“碱性”)。A中发生反应的化学方程式为。
(2)小刚将纯净干燥的氨气通入B中,观察到玻璃管内黑色固体变为亮红色,管口有液滴,同时生成空气中含量最多的气体,B中发生反应的化学方程式为。
(3)小组同学测定铜元素相对原子质量(Ar)的实验设想是:先称量反应物CuO的质量M(CuO),反应完全后测定生成物水的质量M(H2O),由此计算出Cu的相对原子质量。
①小组每位同学从所提供的仪器中选择并组装了一套用于本实验的装置,其中简单、合理的是(填序号,装置可重复使用)。
A.acdbbeecd B.aeebbcdee C.aeebbeecd D.abbeecd
②在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
A.CuO未完全起反应
B.CuO不干燥
C.氢氧化钠固体不干燥
D.CuO中混有不反应的杂质
E.NH4C1与Ca(OH)2混合物不干燥
③在本实验中,还通过测定_______________和_____________的质量达到目的。
小伟利用下图所示装置进行系列探究活动。从分液漏斗依次向集气瓶中加入①适量滴有酚酞的氢氧化钠溶液;②过量的氢氧化钙溶液;③一定量的稀盐酸。回答下列问题: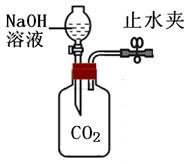
(1)实验①发生反应的化学方程式为。
(2)实验②的探究目的是。
(3)整个实验过程中,酚酞起到的作用是。
(4)实验③结束时,集气瓶内溶液澄清,则溶液中溶质的组成可能是(写其中的一种),确定该组成的方法是。
某研究性学习小组查阅资料得知:
焦炭(主要成分是碳单质,杂质不与水反应)与水蒸气在高温条件下反应,能产生一种俗称为水煤气的气体燃料(水煤气中不含甲烷等有机物)。
为探究水煤气的成份,该小组开展了如下活动:
(1)设计焦炭与水蒸气反应的装置,见图1(图中夹持仪器和加热仪器已省略)。
(2)作出假设:依据所学知识分析,水煤气中一定含有水蒸气,可能含有H2、CO、CO2。
(3)实验探究:同学们为探究水煤气的成份,设计了如下实验装置(图2)并进行实验。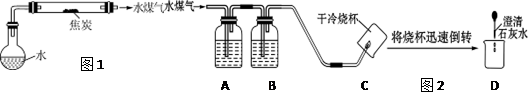
请分析图2所示装置的实验原理,填写下表中的空格:
| 仪器编号 |
所盛试剂的名称 |
试剂或装置的作用 |
| A |
检验是否有CO2 |
|
| B |
浓硫酸 |
吸收水分 |
| C |
||
| D |
(4)结果分析:实验证明水煤气中有H2、CO、CO2。
①能证明CO2存在的现象是。②能证明CO存在的现象是。
③能证明H2存在的现象是。
小明买了一种“汽泡爽”的冲调饮料。小明观察了饮料说明后,他借助化学实验的方法,探究“汽泡爽”产生气体的成分,以及加水温度对产生气体量的影响。
【饮料说明】①主要原料:柠檬酸(C6H8O7)和小苏打(NaHCO3);
②使用说明:将一包“汽泡爽”粉末倒入玻璃杯中,加入200 mL冷水,看到有大量气泡快速生成,待粉末完全溶解,就得到一杯果味饮料。
【实验一】探究“汽泡爽”产生气体的成分。
(1)小明阅读资料发现:“汽泡爽”原料中的柠檬酸(C6H8O7)和小苏打(NaHCO3)粉末混合后加水,可以发生以下反应,填写生成气体的化学式。
3NaHCO3 + C6H8O7 ="===" C6H5O7Na3 + 3H2O + 3↑
(2)为了检验该气体,小明选择的试剂是。写出该反应的化学方程式_________________________________________________。
【实验二】探究加水温度对产生气体量的影响。
(1)小明先用冷水和热水各冲了一杯饮料,品尝时发现冷水冲的饮料中气泡较多,热水冲的饮料中气泡较少。当他摇动杯子时,发现有大量气泡从水中逸出。他查阅资料发现:随着温度升高,气体在一定量的水中溶解的量会迅速降低。于是小明设计了如下实验方案,请填写表中空白。
| 实验序号 |
加入水的体积 |
加入水的温度 |
收集到的气体的体积 |
| 1 |
200 mL |
15℃ |
a(待记录) |
| 2 |
50℃ |
b(待记录) |
(2)在老师的帮助下,小明采用相同的两套实验装置(如下图)分别完成上述实验,在A中加入水,再加入一袋“汽泡爽”,迅速塞紧胶塞。量筒C用于收集A中产生的气体所排出的液体,冷却至室温后读取数据。B中油层的作用是。
A B C
(3)通过实验,小明测得:a =" 64" mL,b =" 132" mL,由此获得结论:“汽泡爽”产生气体的量与加水温度有关系。但是老师看到小明的实验报告后却指出:两套装置中,“汽泡爽”产生气体的总量应该近似相等,与温度关系不大,其本质原因是。
(4)通过反思,为了证明老师的观点,小明继续利用(3)中已反应完的两套装置,又做了一步实验,发现两套装置最终收集到的气体的总量确实相近,他的实验操作是。