小明买了一种“汽泡爽”的冲调饮料。小明观察了饮料说明后,他借助化学实验的方法,探究“汽泡爽”产生气体的成分,以及加水温度对产生气体量的影响。
【饮料说明】①主要原料:柠檬酸(C6H8O7)和小苏打(NaHCO3);
②使用说明:将一包“汽泡爽”粉末倒入玻璃杯中,加入200 mL冷水,看到有大量气泡快速生成,待粉末完全溶解,就得到一杯果味饮料。
【实验一】探究“汽泡爽”产生气体的成分。
(1)小明阅读资料发现:“汽泡爽”原料中的柠檬酸(C6H8O7)和小苏打(NaHCO3)粉末混合后加水,可以发生以下反应,填写生成气体的化学式。
3NaHCO3 + C6H8O7 ="===" C6H5O7Na3 + 3H2O + 3 ↑
(2)为了检验该气体,小明选择的试剂是 。写出该反应的化学方程式_________________________________________________。
【实验二】探究加水温度对产生气体量的影响。
(1)小明先用冷水和热水各冲了一杯饮料,品尝时发现冷水冲的饮料中气泡较多,热水冲的饮料中气泡较少。当他摇动杯子时,发现有大量气泡从水中逸出。他查阅资料发现:随着温度升高,气体在一定量的水中溶解的量会迅速降低。于是小明设计了如下实验方案,请填写表中空白。
| 实验序号 |
加入水的体积 |
加入水的温度 |
收集到的气体的体积 |
| 1 |
200 mL |
15℃ |
a(待记录) |
| 2 |
|
50℃ |
b(待记录) |
(2)在老师的帮助下,小明采用相同的两套实验装置(如下图)分别完成上述实验,在A中加入水,再加入一袋“汽泡爽”,迅速塞紧胶塞。量筒C用于收集A中产生的气体所排出的液体,冷却至室温后读取数据。B中油层的作用是 。
A B C
(3)通过实验,小明测得:a =" 64" mL,b =" 132" mL,由此获得结论:“汽泡爽”产生气体的量与加水温度有关系。但是老师看到小明的实验报告后却指出:两套装置中,“汽泡爽”产生气体的总量应该近似相等,与温度关系不大,其本质原因是 。
(4)通过反思,为了证明老师的观点,小明继续利用(3)中已反应完的两套装置,又做了一步实验,发现两套装置最终收集到的气体的总量确实相近,他的实验操作是 。
化学实验课上老师要求分组除去铁制品和锈铜币表面的锈层并对废液进行处理。请你参与并回答相关问题。
(1)实验一:表面除锈
甲组:将锈铁器放入适量稀硫酸中,微热。观察到①溶液变成黄色,铁锈逐渐消失。一段时间后,②锈层完全消失,铁器表面有细小气泡产生,③黄色溶液逐渐变为浅绿色。
a)现象①发生的化学反应方程式为:___________,
b)②中铁器表面的气泡是什么气体___;
c)大家对现象③不理解,老师提示大家:金属单质铁和铜都可以将+3价的铁元素转变为+2价铁元素,其中铜发生的反应过程为2FeCl3+Cu→ 2FeCl2 + CuCl2 。
请你根据老师的提示推测产生现象③的原因。(只写出有关反应的化学方程式)
乙组:(1)在锈铜钱中加入适量稀硫酸。观察到①绿色锈层很快消失,同时产生大量气泡,溶液变成蓝色 。②将气体收集,通入澄清石灰水,石灰水变浑浊。由此,小军等同学推断,绿色铜锈层中肯定含有的元素有_________。
(2)实验二:废液回收
废液桶中收集了溶有大量FeSO4、CuSO4的废水,若直接排放到下水道,不仅造成重金属污染而且浪费资源。小组讨论后设计了如下回收硫酸亚铁晶体和铜的实验方案:
请完成下列有关问题:
①金属X是,其加入废水后发生反应的化学方程式为;
利用溶液Y除去铜中杂质,有关反应的化学方程式为。
某同学设计了测定空气中氧气含量的实验,实验装置如下图。
图1图2
该同学的实验步骤如下:
①将1图中的集气瓶分为5等份,并作好标记。
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞。
③充分反应后,待集气瓶冷却至室温,打开止水夹。请回答下列问题:
(1)该实验中红磷需稍过量,目的是,写出发生反应的表达式,该反应的基本类型是。
(2)步骤③中打开止水夹后观察到的现象是,由此可得出空气中氧气的体积约为,集气瓶中的气体主要是氮气,由此实验可以推测氮气的性质:其中物理性质是,化学性质是。
(3)这个实验可否用硫或者木炭来代替红磷(填“是”或者“否”)原因是
。
某同学对实验进行反思后,提出了改进方法(如图2所示 ),你认为改进后的优点是:
某兴趣小组做以下实验探究分子有运动。请回答实验中的有关问题。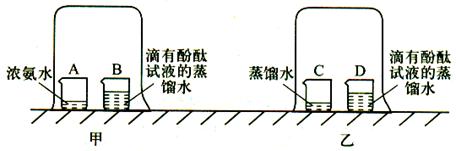
(1)实验Ⅰ:在盛有少量蒸馏水的小烧杯中滴入2 ~ 3滴酚酞试液,再向其中滴加浓氨水。由实验得出的结论有
(2)实验Ⅱ(如图甲所示):烧杯B中的现象是;产生这一现象的原因是
(3)为使实验结论准确可靠,兴趣小组设计实验Ⅲ(如图乙所示)作为对比实验。你认为有无必要,理由是。
下表是研究性学习小组研究影响过氧化氢分解速率的因素时采集的一组数据:用10mL 过氧化氢溶液制取150mL氧气所需的时间(秒)
 浓度 浓度反应条件 |
30% H2O2 |
15% H2O2 |
10% H2O2 |
5% H2O2 |
| 无催化剂、不加热 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
| 无催化剂、加热 |
360s |
480s |
540s |
720s |
| MnO2催化剂、不加热 |
40s |
60s |
120s |
180s |
| MnO2催化剂、加热 |
10s |
25s |
60s |
120s |
(1)该研究小组在设计方案时,考虑了、、等因素对过氧化氢分解速率的影响。
(2)从上表的数据中,你能得出什么结论?
①
②
小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题。她设计并完成了下表所示的探究实验:
| 实验操作 |
实验现象 |
实验结论或总结 |
||
| 结论 |
总结 |
|||
| 实验一 |
取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 |
有少量气泡产生,木条不复燃 |
过氧化氢能自行分解产生氧气,但是。 反应的文字表达式 为:。 |
二氧化锰是过氧化氢分解的催化剂 |
| 实验二 |
向盛水的试管中加入二氧化锰,伸入带火星的木条 |
没有明显现象 |
||
| 实验三 |
二氧化锰能加快过氧化氢的分解 |
(1)请你帮小丽同学填写上表中未填完的空格。
(2)在小丽的探究实验中,“实验一”和“实验二”起的作用是 。
(3)小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,
其目的是: ;
第二方面的实验是利用“实验三”反应后试管内的剩余物继续实验。接下来的实验操作、现象和结论是: