某研究性学习小组查阅资料得知:
焦炭(主要成分是碳单质,杂质不与水反应)与水蒸气在高温条件下反应,能产生一种俗称为水煤气的气体燃料(水煤气中不含甲烷等有机物)。
为探究水煤气的成份,该小组开展了如下活动:
(1)设计焦炭与水蒸气反应的装置,见图1(图中夹持仪器和加热仪器已省略)。
(2)作出假设:依据所学知识分析,水煤气中一定含有水蒸气,可能含有H2、CO、CO2。
(3)实验探究:同学们为探究水煤气的成份,设计了如下实验装置(图2)并进行实验。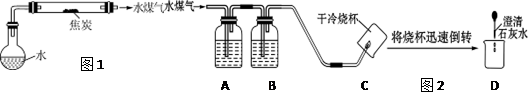
请分析图2所示装置的实验原理,填写下表中的空格:
| 仪器编号 |
所盛试剂的名称 |
试剂或装置的作用 |
| A |
|
检验是否有CO2 |
| B |
浓硫酸 |
吸收水分 |
| C |
|
|
| D |
|
|
(4)结果分析:实验证明水煤气中有H2、CO、CO2。
①能证明CO2存在的现象是 。②能证明CO存在的现象是 。
③能证明H2存在的现象是 。
"侯氏制碱法"首先达到的是碳酸氢钠,然后将碳酸氢钠加热分解得到产品碳酸钠;
.碳酸钠置露在空气中能与空气中的二氧化碳和水反应生成碳酸氢钠:
.
某中学化学研究性学习小组对一瓶开启后久置的碳酸钠是否变质及变质程度进行探究.
【提出问题】假设Ⅰ:完全变质;Ⅱ没有变质;假设Ⅲ:.
【实验探究】实验一:取少量样品于试管中,加水溶解后再加入少量
溶液,产生白色沉淀,说明假设不成立.反应的化学方程式为.
实验二:取少量样品于试管中,用导管连接后固定在铁架台上,导管的另一端插入澄清石灰水中.加热样品,有气体产生,澄清的石灰水变浑浊,说明假设不成立.
【实验结论】假设成立,样品的成分是.
【交流反思】欲除去
变质后的杂质,最合适的方法是.
小强在一次查阅资料时得知:二氧化碳与氢氧化钠反应,若二氧化碳过量,生成的碳酸钠会继续与二氧化碳反应生成碳酸氢钠,反应原理为:
.出于好奇,他和同学一起向一定量的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后,低温蒸发结晶,得到了白色固体.
【提出问题】白色固体是什么?
【作出猜想】
猜想Ⅰ:只有
;
猜想Ⅱ:可能是
和
的混合物;
猜想Ⅲ:
【査阅资料】
(1)碳酸氢钠不稳定受热易分解
(2)
与
的热稳定性较好
(3)
和
的水溶液呈中性
【设计实验】
取一定量的白色固体,加热,若固体质量不变,猜想错误;若固体质量减少,则二氧化碳与氢氧化钠反应后,过量.
【交流讨论】
小方认为,要想知道白色固体中是否有氢氧化钠,可将白色固体配成溶液后,直接用pH试纸测试即可作出判断,你认为是否可行? ;理由是.
【继续探究】白色固体中是否有氢氧化钠?
| 实验操作 |
实验现象 |
目的/结论 |
| ①取白色固体适量配制成溶液.往所得溶液中滴加过量的 ,充分反应后,过滤. |
有白色沉淀生成 |
除去白色固体中的 |
| ②取滤液,往滤液中滴入几滴 |
|
白色固体中没有氢氧化钠 |
【交流与反思】
由于氢氧化钠能与二氧化碳反应,所以实验室保存氢氧化钠一定要注意.
维生素C易溶于水,水溶液显酸性,易被氧气、碘氧化;某同学为了探究VC的性质,进行了如下实验.
Ⅰ、用某制药厂生产的VC片(每片含VC0.1g及不溶性辅料)配制0.5%的VC溶液。
(1)若取5片VC片,应大约去蒸馏水mL.(取整数)
(2)除去浑浊液中的不溶性辅料,得到澄清的VC溶液,其操作名称是 。
Ⅱ、设计实验证明VC溶液具有酸性。
(3)限用试剂:无色酚酞试液、稀氢氧化钠溶液。请你完成下表。
| 实验步骤 |
预期现象及结论 |
| ,说明VC溶液具有酸性 |
Ⅲ、探究VC溶液在一定温度下(18℃)露置时间对VC含量的影响,采用控制变量法进行试验,具体如下表所示。
| 实验序号 |
碘水浓度及用量 |
0.6%淀粉溶液 |
VC溶液恒温露置时间/h |
蓝色消失需要VC溶液滴数 |
| ① |
0.06%、4.8mL |
3滴 |
0 |
10 |
| ② |
0.06%、4.8mL |
3滴 |
12 |
12 |
| ③ |
3滴 |
24 |
18 |
|
| ④ |
0.06%、4.8mL |
3滴 |
36 |
41 |
(4)实验③中碘水的浓度及用量分别是。
(5)VC质量分数随露置时间(0——36h)的变化图像,正确的是(填字母标号)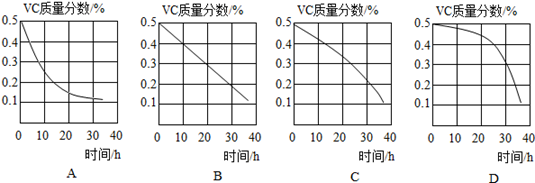
(6)为了提高定量探究vc溶液的准确性。配制VC溶液时,必须先除去溶解在蒸馏水中的少量氧气,具体处理方法是 。
(5分)实验室制取氧气,可供选择的实验装置如图所示。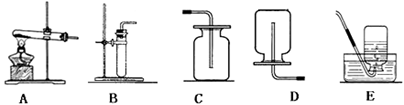
若用氯酸钾制取氧气,反应的化学方程式是,在加热氯酸钾制取氧气的过程中,发现产生氧气的速率很慢,经检查不是KClO3变质,也不是装置气密性不好,你认为最可能的原因是。
在做硫粉在氧气中燃烧的实验时,一般预先在集气瓶底部加水处理产生的二氧化硫气体,
用选代替水吸收产生的气体效果会更好。
已知一氧化氮气体难溶于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置________(填字母序号),说明一氧化氮已收集满的现象是。
实验室里有一瓶常用的无色溶液,因保管不当,其残缺的标签中只剩下“Na”和“10%”字样(如图所示).
小强和小华同学很感兴趣,决定对其成分进行探究.
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 ()
A.酸B.碱C.盐
【查阅资料】
Ⅰ初中常见含钠的化合物有:NaCl、NaOH、Na2CO3、NaHCO3.
ⅡNa2CO3和NaHCO3的水溶液都呈碱性.
Ⅲ室温(20℃)时,测定四种物质的溶解度数据如下:
| 物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
| 溶解度g |
36 |
109 |
215 |
9.6 |
小华根据试剂瓶标注的质量分数为10%和上表中的溶解度数据判断,这瓶试剂不可能是
【作出猜想】①可能是NaCl;②可能是Na2CO3;③可能是
【实验探究】
(1)小强用洁净的玻璃棒蘸取试液于pH试纸上,测得pH>7,则这瓶试剂不可能是
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验.
| 实验步骤 |
实验现象 |
结论及化学方程式 |
| 取少量溶液于试管中,滴加 |
产生大量气泡 |
反应的化学方程式: |
| 把产生的气体通入澄清的石灰水中. |
澄清的石灰水变浑浊 |
猜想②正确. 反应的化学方程式: |