下列根据实验操作和现象所得出结论正确的是
| 编号 |
实验操作 |
实验现象 |
解释与结论 |
| A |
某溶液加入浓NaOH溶液加热,在试管口放一片湿润的红色石蕊试纸 |
试纸变蓝 |
NH3是碱 |
| B |
硝酸银溶液中加足量NaCl溶液,再加KI溶液 |
先出现白色沉淀,后变为黄色沉淀 |
Ksp(AgCl) >Ksp(AgI) |
| C |
2mL 2% CuSO4中加4~6滴2%NaOH,振荡后加入0.5mL X溶液,加热煮沸 |
未出现砖红色沉淀 |
X不含有醛基 |
| D |
等体积pH=3的HA和HB两种酸分别与足量的锌反应 |
相同时间内,HA收集到氢气多 |
HA是强酸 |
反应:L(固)+aG(气) bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数,K表示该反应平衡常数。据此可判断
bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数,K表示该反应平衡常数。据此可判断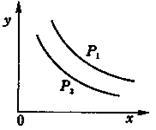
不同温度下G的体积分数
A.a>b
B.上述反应是吸热反应
C.升温K减小
D.加压K增大
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
| A.c(H+) | B.K?(HF) | C. |
D.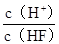 |
恒温恒压下,在容积可变的器皿中,反应2NO2(气)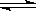 N2O4(气) 达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4(气) 达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
| A.不变 | B.增大 | C.减小 | D.无法判断 |
已知:C(s)+CO2(g) 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
| A.升高温度和减小压强 | B.降低温度和减小压强 |
| C.降低温度和增大压强 | D.升高温度和增大压强 |
对可逆反应4NH3(g) + 5O2(g) 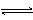 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
| A.达到化学平衡时,5v正(O2)=4v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 |
| D.达到平衡前,化学反应速率关系:3v正(NH3)=2v正(H2O) |