还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下: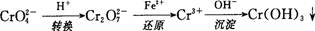
已知转化过程中的反应为2CrO42-(aq)+2H+(aq) Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B.若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 |
| D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:
+
 +
△
<0反应达到平衡后,为提高
的转化率,下列措施中正确的是( )
+
△
<0反应达到平衡后,为提高
的转化率,下列措施中正确的是( )
| A. | 增加压强 | B. | 降低温度 | C. | 增大 的浓度 | D. | 更换催化剂 |
能正确表示下列反应的离子方程式是()
| A. | 硫酸铝溶液中加入过量氨水 |
| B. | 碳酸钠溶液中加入澄清石灰水 |
| C. | 冷的氢氧化钠溶液中通入氯气 |
| D. | 稀硫酸中加入铁粉 |
下列关于化学键的叙述,正确的一项是( )
| A. | 离子化合物中一定含有离子键 |
| B. | 单质分子中均不存在化学键 |
| C. | 含有极性键的分子一定是极性分子 |
| D. | 含有共价键的化合物一定是共价化合 |
“氢能”将是未来最理想的新能源。
Ⅰ 在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为。
Ⅱ 氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
(1)若升高温度至950℃,达到新平衡状态时K(填“>”、“<”或“=”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 molCO、3.0mol H2O、1.0 molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是。
③若设x="5.0" mol和x="6.0" mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a(填“>”、“<”或“=”)b。
Ⅲ 海水淡化获得淡水的过程也可以产生氢气。下面是利用电渗析法处理海水获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题: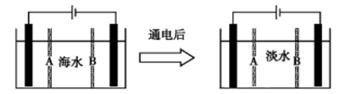
(1)阳离子交换膜是指______________ (填A或B)。
(2)写出通电后阳极的电极反应式:_________________________________________,在阴极区观察到的现象是:_________________________________________。
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是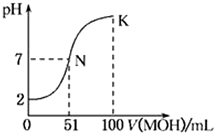
| A.HA为一元强酸 |
| B.N点水的电离程度小于K点水的电离程度 |
C.随着MOH溶液的滴加,比值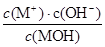 不变 不变 |
| D.若K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L |