中国环境监测总站数据显示,PM2.5、SO2、NOx等是连续雾霾过程影响空气质量显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对它们进行研究具有重要意义。请回答:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH |
SO |
NO |
Cl- |
| 浓度(mol/L) |
4×10−6 |
6×10−6 |
2×10−5 |
4×10−5 |
3×10−5 |
2×10−5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
(3)消除氮氧化物和硫氧化物有多种方法。
Ⅰ.NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
①由图可知SCR技术中的氧化剂为 。
②用Fe做催化剂时,在氨气足量的情况下,当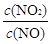 =1:1时,脱氮率最佳,已知每生成28g N2放出的热量为QkJ,该反应的热化学方程式为 。
=1:1时,脱氮率最佳,已知每生成28g N2放出的热量为QkJ,该反应的热化学方程式为 。
Ⅱ.工业上变“废”为宝,吸收工业中SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
①装置Ⅰ中的主要反应的离子方程式为 。
②装置Ⅲ还可以使Ce4+再生,若用甲烷燃料电池电解该装置中的溶液,当消耗1mol CH4时,
理论上可再生 mol Ce4+。
Ⅲ.用活性炭还原法可以处理氮氧化物。如发生反应:
C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ/mol。
N2(g)+CO2(g) △H=Q kJ/mol。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 时间(min) 时间(min)浓度(mol/L) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.58 |
0.40 |
0.40 |
0.48 |
0.48 |
| N2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
| CO2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
①Tl℃时,该反应的平衡常数K= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是________(答一种即可)。
下表为周期表的一部分,其中的编号代表对应的元素。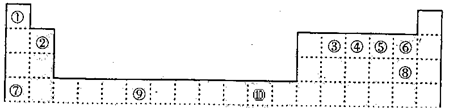
(1)写出上表中的元素⑩原子的外围电子排布式。
(2)元素⑦与⑧形成的化合物的晶体类型是。
(3)元素④的第一电离能(填“>”、“=”或“<”)元素⑤的第一电离能;元素④与元素①形成的X分子的空间构型为。X沸点高于同族其它元素与元素①形成的化合物的沸点,其原因是。
(4)第四周期所有元素的基态原子中,4p轨道半充满的是(请填元素符号,下同),3d轨道半充满的原子是,4s轨道半充满的是。
(5)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,其离子方程式为.
(每空2分,共14分)根据下面的反应路线及所给信息填空:
(1)反应①的类型是___________,反应⑥的类型是______________。
(2)C的结构简式是____________,D的结构简式是_______________。
(3)写出反应②的化学方程式:。
(4)反应⑦中,除生成α-溴代肉桂醛的同时,还有可能生成其他有机物,请写出其结构简式:①;②。
(每空2分,共10分)
某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
(1)烃A的分子式为_____________。
(2)若取一定量的烃A完全燃烧后,生成CO2和H2O各3 mol,则有________g烃A参加了反应,燃烧时消耗标准状况下的氧气___________L。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为______________(写出一种即可)
将煤粉隔绝空气加强热,除主要得到焦炭外,还能得到下表所列的物质:
| 序号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
| 名称 |
甲烷 |
一氧化碳 |
乙烯 |
苯 |
甲苯 |
苯酚 |
氨水 |
(1)表中所列物质不属于有机物的是(填序号):。
(2)能与溴水反应使之褪色的烃是(填序号):。
(3)彼此互为同系物的是(填序号):。
(4)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号),该物质发生加聚反应的化学方程式为:。
(5)甲苯的一氯取代产物有种。
(1)下面各个小题已经给出了化学反应的反应物,试写出完整的化学反应方程式并配平:(每小题2分,共6分)
过量乙酸与甘油的酯化反应
蔗糖水解:
CH3CH(OH)CH3的催化氧化:
(2).硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HIⅡ.2HI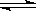 H2+I2Ⅲ.2H2SO4===2SO2+O2+2H2O
H2+I2Ⅲ.2H2SO4===2SO2+O2+2H2O
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,生成的I2为气体,H2物质的量随时间的变化如图所示。0-2 min内的平均反应速率υ(HI)=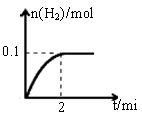
(2)实验室用Zn和硫酸制取H2,为了加快反应速率,下列措施不可行的是(填序号)
a.加入浓硝酸b.加入少量CuSO4固体 c.用粗锌代替纯锌
d.加热 e.把锌粒弄成锌粉 f.用98.3%浓硫酸