脱去冶金工业排放烟气中SO2的方法有多种。
(1)热解气还原法。已知CO还原SO2生成S(g)和CO2过程中,每转移1mol电子需吸收2.0 kJ的热量,则该反应的热化学方程式为 。
(2)离子膜电解法。利用硫酸钠溶液吸收SO2,再用惰性电极电解。将阴极区溶液导出,经过滤分离硫磺后,可循环吸收利用,装置如图1所示,则阴极的电极反应式为 ,阳极产生气体的化学式为 。
(3)氧化锌吸收法。配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO+SO2 = ZnSO3(s),测得pH、吸收效率η随时间t的变化如图2所示。
①该反应常温能自发进行的原因是 。
②纯ZnO的悬浮液pH约为6.8,结合图2和图3,下列说法正确的是 。
A.向ZnSO3与水混合体系中加稀硫酸,硫元素会以SO2形式逸出
B.pH-t曲线ab段发生的主要反应为ZnO+SO2=ZnSO3
C.pH-t曲线cd段发生的主要反应为ZnSO3+SO2+H2O =" Zn" (HSO3)2
D.pH=7时,溶液中c(SO32-) = c(HSO3-)
③为提高SO2的吸收效率η,可采取的措施为 。
A.增大悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH至6.0以下
乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答:
已知:
(1)写出A的电子式。
(2)反应II的化学方程式是__________。
(3)D为高分子化合物,可以用来制造多种包装材料,其结构简式是__________。
(4)E是有香味的物质,在实验室用下图装置制取。
①反应IV的化学方程式是__________,该反应类型为______。
②该装置图中有一个明显的错误是。
(5)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 |
试管甲中试剂 |
试管乙中试剂 |
有机层的厚度/cm |
| A |
2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 |
饱和Na2CO3溶液 |
3.0 |
| B |
2 mL乙醇、1 mL乙酸 |
0.1 |
|
| C |
2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 |
0.6 |
|
| D |
2 mL乙醇、1 mL乙酸、盐酸 |
0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是3mL和_____mol·L-1。
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
在下列条件下能否发生离子反应?请说明理由。
(1)CH3COONa溶液与HCl溶液混合。
(2)向澄清的Ca(OH)2溶液中通入少量CO2。
(3)CuCl2溶液与H2SO4溶液混合。
硫化氢(H2S)是一种有毒的可燃性气体,用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为2H2S+3O2+4KOH==2K2SO3+4H2O。
(1)该电池工作时正极应通入。
(2)该电池的负极电极反应式为:。
(3)该电池工作时负极区溶液的pH(填“升高”“不变”“降低”)
(4)有人提出K2SO3可被氧化为K2SO4,因此上述电极反应式中的K2SO3应为K2SO4,某学习小组欲将电池工作一段时间后的电解质溶液取出检验,以确定电池工作时反应的产物。实验室有下列试剂供选用,请帮助该小组完成实验方案设计。
0.01mol·L-1KMnO4酸性溶液,1mol·L-1HNO3,1mol·L-1H2SO4,1mol·L-1HCl,0.1mol·L-1Ba(OH)2,0.1 mol·L-1 BaCl2。
| 实验步骤 |
实验现象及相关结论 |
| ①取少量电解质溶液于试管中,用pH试纸测其pH。 |
试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH。 |
| ②继续加入()溶液,再加入()溶液,振荡。 |
若有白色沉淀产生,则溶液中含有K2SO4。 若无白色沉淀产生,则溶液中没有K2SO4 |
| ③另取少量电解质溶液于试管中,先加1 mol·L-1的H2SO4酸化,再滴入2~3滴0.01 mol·L-1KMnO4酸性溶液,振荡 |
() |
(5)若电池开始工作时每100mL电解质溶液含KOH 56g,取电池工作一段时间后的电解质溶液20.00mL,加入BaCl2溶液至沉淀完全,过滤洗涤沉淀,将沉沉在空气中充分加热至恒重,测得固体质量为11.65g,计算电池工作一段时间后溶液中KOH的物质的量浓度( )。
(结果保留四位有效数字,假设溶液体积保持不变,已知:M(KOH)=56,M(BaSO4)=233,M(BaSO3)=217)
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
据此回答:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
①20 MPa~50 MPa
②500℃的高温
③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示 (T-温度)。
则T2_____T1 (填>、=、<),判断的依据是:______________________。
(3)相同温度下,有恒容密闭容器A、恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。
则:a_____b(填>、=、<),Q1_____ Q2(填>、=、<),Q1_____92.4(填>、=、<)。
G、Q、X、Y、Z均为氯的含氧化合物。我们不了解它们的化学式,但知道它们在一定条件下具有如下转化关系(未配平)
①G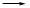 Q+NaCl
Q+NaCl
②Q +H2O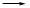 X+H2
X+H2
③Y+NaOH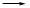 G+Q+H2O
G+Q+H2O
④Z+NaOH 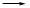 Q+X+H2O
Q+X+H2O
(1)这五种化合物中氯的化合价由高到低的顺序是;
(2)臭氧与二氧化氯作用,可以得到红色油状的六氧化二氯Cl2O6,遇有机物会爆炸。它与氢氧化钠溶液反应可得到氯的两种含氧酸盐,其离子方程式是:。
(3)亚氯酸钠NaClO2,可以作漂白剂,在常温下不见光可以保存约1年。但在酸性条件下因为生成亚氯酸而发生分解反应:HClO2 ClO2+H++Cl―+H2O,分解时,刚加入硫酸时的反应很慢,随后突然迅速放出气态的二氧化氯。写出配平的化学方程式。
ClO2+H++Cl―+H2O,分解时,刚加入硫酸时的反应很慢,随后突然迅速放出气态的二氧化氯。写出配平的化学方程式。
如果有2molHClO2发生反应,则转移电子的个数是,后期反应速率迅速加快的原因是。
| A.酸使亚氯酸的氧化性增强 | B.溶液中的氢离子还起了催化作用 |
| C.溶液中的氯离子还起了催化作用 | D.逸出的气体使反应生成物的浓度降低 |