(16分)某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
(1)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
| 选择的装置 (填编号) |
实验现象 |
实验结论 |
| |
|
样品含 NaHCO3 |
(2)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混和物过滤、 (填操作)、干燥、称量为m2g。该纯碱样品的纯度为 。
(3)该小组同学在0.1 mol/L NaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去。为探究原因,进行了下列实验:
实验1: 加热0.1 mol/L NaHCO3溶液,测得溶液pH变化如下表
| 温度(℃) |
10 |
20 |
30 |
50 |
70 |
80 |
100 |
| pH |
8.3 |
8.4 |
8.5 |
8.9 |
9.4 |
9.6 |
10.1 |
但当温度恢复到10 ℃,测得溶液pH=9.8。
实验2:加热0.1 mol/L NaHCO3溶液,将产生的气体通入澄清石灰水,澄清石灰水变浑浊。
①用离子方程式表示0.1 mol/L NaHCO3溶液中存在的平衡(除水电离平衡外) 、
________________。这两个平衡以__________为主。
②结合实验1、2分析,加热0.1 mol/L NaHCO3溶液,pH增大的原因可能是_____________(答一条)。
用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH含量时,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转化为B aCO3沉淀,然后用酚酞作示剂,用标准盐酸滴定。试回答:
aCO3沉淀,然后用酚酞作示剂,用标准盐酸滴定。试回答:
(1)向混有BaCO3沉淀的NaOH溶液中滴加盐酸,为什么不会使BaCO3溶解而影响NaOH含量的测定
(2)达到 滴定终点时溶液的颜色如何突变?
滴定终点时溶液的颜色如何突变?
(3)滴定时,若滴定管中滴定液一直下降到活塞处才到终点,则能否由此得出准确的测定结果?为什么?
(4)能否改用甲基橙作指示剂?。若使用甲基橙作指示剂,测定结果如何?
喷泉是一种常见的自然现象,其产生原因是存在压强差。
制取氨气并完成喷泉实验(图中夹持装置已略去)。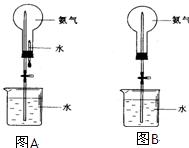
Ⅰ.①写出实验室制取氨气的化学方程式:__________________。收集氨气用_______法,要得到干燥的氨气可选用__________作干燥剂。
②.用图A装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是___________________。
如果观察不到“喷泉”或现象不明显,实验不成功的原因可能有:_________________;________________.
③.如果只提供图B的装置请说明引发喷泉的方法_____________
④比较图A和图B两套装置,从产生喷泉原理来分析,它们的不同点是:_______________
Ⅱ
喷泉实验装置设计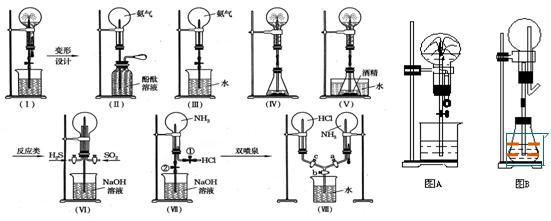
①.图A为化学教学中所用的喷泉实验装置,在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体,下列组合中前一物质表示干燥气体,后一液体表示胶头滴管及烧杯中的液体,其中能形成白色喷泉的是
A.氨和酚酞试液 B.氨和氯化铁溶液
C.HCl和AgNO3溶液 D.HCl和酚酞试液
②.图B为重新设计的喷泉装置。在图B的锥形瓶中分别加入足量如下物质,反应后可能产生喷泉的是
A.NaHSO4与NaOH溶液B.NH4HCO3和稀盐酸
C.MnO2固体与浓盐酸D.稀NH4Cl溶液与稀NaOH溶液
形成这种喷泉的反应条件是______________________
比较图A和图B两套装置,从产生喷泉原理来分析,它们的不同点是:____________________
在图B中锥形瓶外放一大烧杯,锥形瓶中加入酒精,大烧杯中加入冷水后,再加入足量下列物质,结果也产生了喷泉,大烧杯中加入的物质可
A.食盐B.硝酸铵C.浓硫酸D.(NH4)2SO4
③在自然界和人类社会中,与上述图B装置原理相似的现象有:_______________________
Ⅲ.请用金属钠与水反应产生H2的反应设计一个喷泉装置。画出简易图不用文字叙述。
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。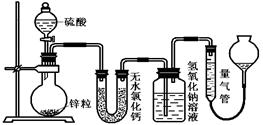
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ 。
A.200 mL B.400 mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:_______________________________________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的数值将(填偏大、偏小或无影响)
(5)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①;②;③。
(16分) 某混合粉末含有Al2O3,还可能有Fe2O3、ZnO,请设计实验探究该混合物的组成。限选择的仪器和试剂:
烧杯、试管、玻璃棒、酒精灯、漏斗、过滤架、滤纸、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、10%KSCN溶液、稀氨水。
提示:ZnO、Zn(OH)2都是两性物质;且Zn(OH)2能溶于烧碱溶液生成Na2ZnO2,能溶于浓氨水生成[Zn(NH3)4](OH)2。
(1)请写出ZnO与烧碱溶液反应的化学方程式:ZnO+2NaOH=
(2)请完成以下实验探究过程
①提出假设:假设1 该混合物中除Al2O3外还含有;
假设2 该混合物中除Al2O3外还含有;
假设3 该混合物中除Al2O3外还含有Fe2O3、ZnO 。
②设计实验方案:基于假设3,设计出实验方案。请在下表对应栏目叙述实验操作、预期现象和结论(实验步骤可以不填满、也可以增加):
| 实验步聚 |
实验操作 |
预期现象和结论 |
| 第一步 |
||
| 第二步 |
||
| 第三步 |
||
| 第四步 |
||
我国制碱工业的先驱——侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
NH3+CO2+NaCl+H2O===NH4Cl+NaHCO3(晶体),
依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。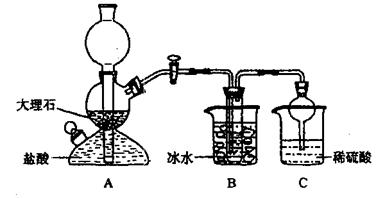
(1)A装置中所发生反应的离子方程式为。
C装置中稀硫酸的作用为。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 温度 溶解度 盐 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
| NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
| NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
| NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
参照表中数据,请分析B装置中使用冰水的目的是。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指寻教师指出应在装置之间(填写字母)连接一个盛有的洗气装置,其作用是。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为。