SO2、NOx、CO2是对环境影响较大的气体,控制和治理SO2、NOx、CO2是减少酸雨、光化学烟雾和解决温室效应的有效途径。
(1)碳元素在元素周期表的位置: 。
(2)标况下2.24LSO2恰好被1L 0.2mol·L-1的NaOH溶液完全吸收,请写出吸收后溶液中离子浓度由大到小的顺序为 。
(3)已知汽车尾气NO 与CO净化反应生成无污染气体,3g NO参加该反应放出37.99 kJ热量,请写出该反应的热化学方程式: 。
(4)某科研小组想以如图所示装置用原电池将SO2转化为重要的化工原料。
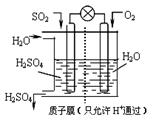
①其负极反应式: ,
②当有1mol SO2被吸收,则通过质子(H+)交换膜的H+离子数为 。
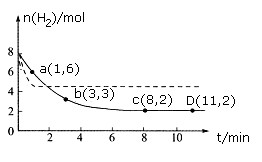
(5)某科研小组用CO2通过下面反应方程式来生产甲醇,CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH= —49.0kJ·mol-1,现将6molCO2和8molH2充入一容积为2L的恒温密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。
CH3OH(g)+H2O(g) ΔH= —49.0kJ·mol-1,现将6molCO2和8molH2充入一容积为2L的恒温密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。
回答下列问题:
①此温度下该反应的平衡常数的数值K= 。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线改变的条件可能是 。
二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为
2KClO3+H2C2O4+2H2SO4 2KHSO4+2ClO2+2CO2+2H2O。
2KHSO4+2ClO2+2CO2+2H2O。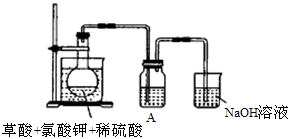
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是_______________________。
②装置A用于溶解产生的二氧化氯气体,其中最好盛放_______(填字母)。
a.20mL 60℃的温水b.100mL冰水
c.100mL饱和食盐水d.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为______________________
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(Cl )。饮用水中ClO2、Cl
)。饮用水中ClO2、Cl 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
步骤1中若要量取20.00mL水样,则应选用的仪器是____________________________。
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为: 2ClO2+2KI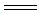 2KClO2+I2,2 Na2S2O3+I2
2KClO2+I2,2 Na2S2O3+I2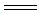 Na2S4O6+ 2NaI,则步骤4中加入的指示剂为_________,滴定达到终点时溶液的颜色变化为___________________________。
Na2S4O6+ 2NaI,则步骤4中加入的指示剂为_________,滴定达到终点时溶液的颜色变化为___________________________。
③步骤5的目的是用I-将溶液中的Cl 还原为Cl-以测定其含量,该反应的离子方程式为___________。
还原为Cl-以测定其含量,该反应的离子方程式为___________。
(17分)化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
I.图A为教材制备乙酸乙酯的实验装置,甲同学认为图B装置比A要好,则冷却水应从_____________口进入;乙同学认为图C装置效果更好,理由是__________________。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)【提出猜想】小组同学认为分解产物可能有以下几种情况:
A.F2O3 SO2 NH3 H2OB.FeO SO3 NH3 H2O
C.FeO SO2 NH3 H2OD.F2O3 SO3 SO2 NH3 H2O
根据所学知识,可确定______________不成立(填序号)
(2)【药品验纯】甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和__________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加____________(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)【实验探究】为检验分解产物,甲同学设计了如下实验装置。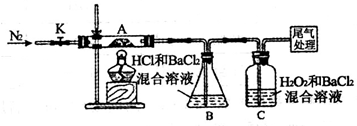
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是_________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为____________。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含_______________。
(4)【实验结论与反思】通过实验现象和认真反思,上述猜想中一定正确的是_________(填序号)。
(16分)硼镁泥是一种工业废料,主要成分是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3,、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中制取MgSO4·7H2O的工艺流程如下:
已知:NaClO与Mn2+反应产生MnO2沉淀。
(1)实验中需用1.00 mol·L-1的硫酸80.0ml。若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有_____________。
(2)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还有__________。
(3)“操作I”的主要操作为蒸发浓缩、冷却结晶、____________。
(4)写出加入NaClO时,溶液中氧化还原反应的离子方程式________________、_______________。
(5)已知:溶液的pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式_______________________。
(6)某同学为探究Ag+和Fe2+反应,按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。电子由石墨经导线流向银。放置一段时间后,向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小—回到零点—逆向偏移。则电压表指针逆向偏移后,银为_______极(填“正”或“负”)。由实验得出Ag+和Fe2+反应的离子方程式是______________________。
(18分)亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备。
已知:①2NO+Na2O2=2NaNO2;
②3 NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是_______________。
(2)装置A中发生反应的化学方程式为__________________________________。实验结束后,将B瓶中的溶液经蒸发浓缩、__________(填操作名称)、过滤可获得CuSO4·5H2O。
(3)仪器C的名称为______________,其中盛放的药品为 ____________(填名称)。
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,________________,则产物是NaNO2(注明试剂、现象)。
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
①第一组实验数据出现异常,造成这种异常的原因可能是_________(填代号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数__________。
(6)设计合理实验比较0.1 mol·L-1NaNO2溶液中NO2-的水解程度和0.1 mol·L-1HNO2溶液中HNO2的电离程度相对大小。(简要说明实验步骤、现象和结论,仪器和药品自选)_______________________。
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。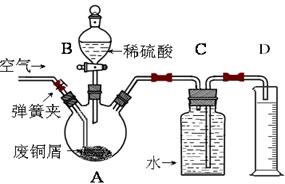
(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。此时装置C中发生的现象是。
(2)反应进行到A中不再产生气泡时,拆除C、D装置后,为了使A中固体全部消失,①接下来的操作是:______________________________。
②该过程中发生反应的离子方程式是;
③为使A中固体加快溶解速率,以下方法运用合理的是。
a. 对A装置加热
b. 向A内加入少量Fe2O3
c. 向A内加入少量CuO
d. 增大空气通入量
e. 向A内加入少量FeSO4
f. 向A内加入少量H2O
(3)待A中固体全部溶解后,再继续通入一段时间空气后,关闭弹簧夹,停止通入空气。将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,此过程离子反应方程式是__________。
(4)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,其具体操作步骤可续写为: