(17分)化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
I.图A为教材制备乙酸乙酯的实验装置,甲同学认为图B装置比A要好,则冷却水应从_____________口进入;乙同学认为图C装置效果更好,理由是__________________。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)【提出猜想】小组同学认为分解产物可能有以下几种情况:
A.F2O3 SO2 NH3 H2O B.FeO SO3 NH3 H2O
C.FeO SO2 NH3 H2O D.F2O3 SO3 SO2 NH3 H2O
根据所学知识,可确定______________不成立(填序号)
(2)【药品验纯】甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和__________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加____________(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)【实验探究】为检验分解产物,甲同学设计了如下实验装置。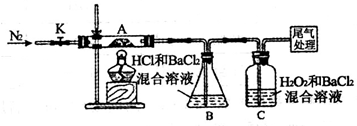
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是_________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为____________。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含_______________。
(4)【实验结论与反思】通过实验现象和认真反思,上述猜想中一定正确的是_________(填序号)。
(14分)世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为_____________________________________。实验室制备气体B的化学方程式为____________________________。为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;②_______________________。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为_________________________________________ 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知I2+2S2O32-=2I-+S4O62-)
①上述步骤3中滴定终点的现象是_______________________________;
②根据上述步骤可计算出原ClO2溶液的浓度为___________g/L(用含字母的代数式表示)。
(14分)过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下: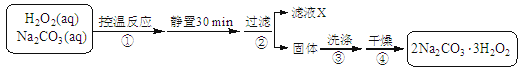
已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)  2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应 2H2O2 = 2H2O + O2↑
50°C时 2Na2CO3·3H2O2 (s) 开始分解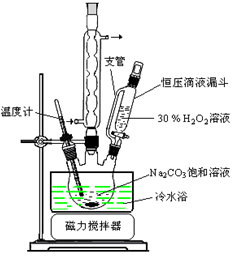
请回答下列问题:
(1)步骤①的关键是控制温度,原因是,其措施有、和。
(2)在滤液X中加入适量NaCl固体可析出过碳酸钠,原因是。
(3)步骤③中选用无水乙醇洗涤产品的目的是。
(4)下列物质中,会引起过碳酸钠失效的有。
| A.NaHCO3 | B.MnO2 | C.Na2SiO3 | D.Na2SO3 |
(5)过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶解→加入BaCl2溶液→ 过滤→ 洗涤→ 干燥→ 称量。需要直接测定的物理量有:(用字母表示并注明其含义).产品中过碳酸钠质量分数的表达式为:。
选考【化学——选修2:化学与技术】某工厂从废含镍有机催化剂中回收镍的工艺流程如图所示(已知废催化剂中舍有Ni70.0%及一定量的Al、Fe、SiO2和有机物,镍及其化台物的化学性质与铁的类似,但Ni2-的性质较稳定)。
已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示,回答下列间题
(1)滤渣a的成分是________,用乙醇洗涤废催化剂的目的是________,从废渣中回收乙醇的方法是________。
(2)为提高酸浸速率,可采取的措施有(答两条)________________。
(3)向A中加人 H2O2时反应的离子方程式为__________.试剂x可以是________。
(4)用方程式表示出由沉淀。制取单质镍的方法_________、________。回收mkg上述废催化剂的过程中,若将溶液pH调整为6时消耗了a kgNi(OH)2,从洗涤到得到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,则最终得到单质镍的质量为________kg(填计算式)。
(5)利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属,某化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生的反应之一如下,请配平该反应。
与电镀相比,化掌镀的最大优点是:________________________________。
(14分)磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69 1℃,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
(1)仪器E的者称是_______,由B的使用可知SO2与氧气之间的反应居于______(填“放”或“吸”)热反应,仪器C的作用是________________________.
(2)仪器组装完毕后,检验甲装置气密性的方法是____________表明装置气密性良好。
(3)试剂X、Y的组合最好是_________。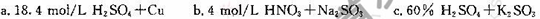
(4)戊是贮气装置,则E中的试剂是_________;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是___________________________.
(5)反应结束后,将丙中混合物分离开的实验操作是_________。若反应中消耗的氯气的体积为896 mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氧3.3g,则磺酰氯的产率为_________(保留三位有效数字)。
某小组通过实验研究Na2O2与水的反应。
| 操作 |
现象 |
| 向盛有4gNa2O2的烧杯中加入50mL蒸馏水得到溶液a |
剧列反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴酚酞 |
ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2与水反应的化学方程式。
(2)ⅱ中溶液褪色可能是溶液a中存在较多的H2O2与酚酞发生了反应。
Ⅰ.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂(填化学式),有气体产生。
Ⅱ.乙同学查资料获悉:用KMnO4可以测定H2O2含量: 取15.00mL溶液a,用稀H2SO4酸化,逐滴加入0.003mol·L-1 KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗20.00 mL KMnO4溶液。
①请配平:MnO4-+H2O2+H+ ="=" Mn2++O2↑+H2O
②溶液a中c(H2O2)=mol·L-1。
③溶液褪色速率开始较慢后变快的原因可能是。
(3)为探究现象ⅱ产生的原因,同学们继续实验:
Ⅲ.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1mol·L-1 NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色。
Ⅳ.向0.1mol·L-1 NaOH溶液中滴入两滴酚酞的,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入O2,溶液颜色无明显变化。
①从实验Ⅲ和Ⅳ中,可得出的结论。
②同学们通过进一步实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应。实验方案是:取少量溶液a于试管中,。