[化学——物质结构与性质]氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节。
Ⅰ.氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是 (填序号)。
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1 mol水分子可形成4 mol氢键
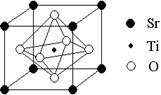
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图,则其化学式为 。
Ⅱ.氢气的存储
(3)Ti(BH4)2是一种储氢材料。
①Ti原子在基态时的核外电子排布式是 。
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为 。
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。
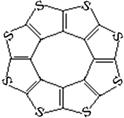
①元素电负性大小关系是:C S(填“>”、“=”或“<”)。
②分子中C原子的杂化轨道类型为 。
③有关键长数据如下:
| |
C—S |
C=S |
C16S8中碳硫键 |
| 键长/pm |
181 |
155 |
176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S与C=S之间,原因可能是: 。
④C16S8与H2微粒间的作用力是 。
(1)能源是现代社会发展的支柱之一。化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是___________(填序号)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌
b.高温煅烧石灰石
c.铝与盐酸反应
(2)某同学进行如下图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是__________(填“吸热”或“放热”)反应,其离子方程式是______________。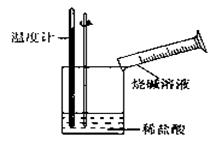
某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示: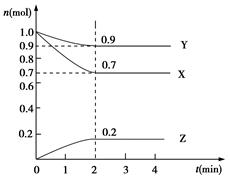
(1)X的转化率是________;
(2)由图中所给数据进行分析,该反应的化学方程式为______;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=________;
(4)当反应进行到第________min,该反应达到平衡。
下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置。试用元素符号、离子符号或化学式回答下列问题。
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 2 |
⑥ |
⑦ |
||||||
| 3 |
① |
③ |
⑤ |
⑧ |
⑨ |
⑩ |
||
| 4 |
② |
④ |
(1)10种元素中,化学性质最不活泼的是___________;(填元素符号)
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是__________;(填化学式)
(3)元素⑦的氢化物(10电子分子)的化学式为___________;该氢化物常温下和元素①的单质反应的化学方程式_____________________________;
(4)元素⑧的最高价氧化物对应水化物的化学式为________;元素⑨的最高正化合价为__________,氢化物的化学式为_____________;
(5)元素①和⑤的最高价氧化物对应的水化物相互反应的离子方程式为________________。
(共16分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,
碱性最强的化合物的电子式是_______________。
(3)最高价氧化物是两性氧化物的元素是_________;
写出它的氧化物与氢氧化钠反应的离子方程式___________________________________。
(4)用电子式表示元素④与⑥的化合物的形成过程:,
该化合物属于(填“共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式。
(12分)某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2和H2O各1.2 mol.试回答:
(1)烃A的分子式为________.
(2)若取一定量的烃A完全燃烧后,生成CO2和H2O各3 mol,则有_______g 烃A参加了反应,燃烧时消耗标准状况下的氧气________L.
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为________.
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,写出一种烃A可能有的结构简式为__________________________.