A、B、C、D、E五种元素原子具有相同的电子层数,A、B的最高价氧化物对应的水化物水溶液呈碱性,且碱性B>A; C、D的最高价氧化物对应的水化物水溶液呈酸性,且酸性C>D;五种元素所形成的简单离子中,E的离子半径最小。则它们的原子序数由大到小的顺序正确的是
A.CDEAB B.ECDAB C.BAEDC D.BADCE
25℃、101kPa下:①2Na(s)+1/2O2(g)=Na2O(s)△H1=-414kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s)△H2=-511kJ·mol-1
下列说法正确的是()
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa下,Na2O2(s)+2Na(s)=2Na2O(s) △H=-317kJ·mol-1 |
根据表中的信息判断下列说法正确的是( )。
| 物质 |
金刚石 |
石墨 |
| 外观 |
无色,透明固体 |
灰黑,不透明固体 |
| 熔点 |
? |
? |
| 燃烧热/(kJ·mol-1) |
395.4 |
393.5 |
A.表示石墨燃烧热的热化学方程式为C(石墨,s)+ O2(g)=CO(g) ΔH=-393.5kJ·mol-1
O2(g)=CO(g) ΔH=-393.5kJ·mol-1
B.由表中信息知C(石墨,s)=C(金刚石,s) ΔH=+1.9kJ·mol-1
C.由表中信息可得如图所示的图像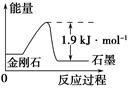
D.由表中信息可推知相同条件下金刚石的熔点高于石墨的熔点
已知下列反应的热化学方程式:6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+O2(g)=2H2O(g)△H2
C(s)+O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为()
| A.12△H3+5△H2-2△H1 | B.2△H1-5△H2-12△H3 |
| C.12△H3-5△H2-2△H1 | D.△H1-5△H2-12△H3 |
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
| A.+43.5kJ·mol-1 | B.-43.5kJ·mol-1 | C.+67.7kJ·mol-1 | D.-67.7kJ·mol-1 |
下列说法正确的是()
| A.酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因 |
| B.CH4、NH3、PH3的热稳定性逐渐增强 |
| C.因为酸性:HC1>HF,所以非金属性:Cl>F |
| D.钠原子在反应中失去的电子比铝原子少,故钠的金属性比铝弱 |