氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
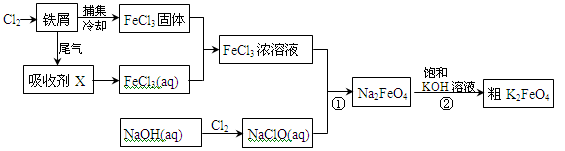
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理____________ __________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为 。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示) 。正确的检验方法是:取少量待测液,加入 (写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
(5)将粗K2FeO4产品经重结晶、过滤、 、 ,即得较纯净的K2FeO4。
某课外活动小组探究镁与CO2、NO2的反应。
I、实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体分别是C和MgO;该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测:写出Mg在NO2中燃烧的化学方程式。反应产生的固体中可能存在物质(填化学式)。
II、设计实验验证以上猜测(用于连接玻璃管的乳胶管均内衬锡纸)
资料信息:2NO2+ 2NaOH = NaNO3 + NaNO2 + H2O
(1)写出A中发生反应的化学方程式:;
(2)装置B中盛装的干燥剂是(填序号)___________________;
①浓硫酸 ②无水CaCl2 ③碱石灰
(3)实验开始时正确的操作步骤是___ ___;
a.打开A装置中分液漏斗的旋塞滴入浓硝酸制取NO2
b.打开活塞K
c.点燃C处酒精灯
d.当C处硬质玻璃管内充满红综色气体后,关闭活塞K
(4)D中NaOH溶液盛的很满,这样做的目的是____________ _____________;
(5)本实验中存在明显缺陷,改进措施是____________________________________。
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O ZnFe2(C2O4)3·6H2O↓(a)
ZnFe2(C2O4)3·6H2O↓(a)
ZnFe2(C2O4)3·6H2O  ZnFe2O4 + 2CO2↑+4CO↑+6H2O (b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O (b)
已知:ZnC2O4和FeC2O4难溶于水。
(1)上述制备原理中不属于氧化还原反应的是(选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ.(NH4)2Fe(SO4)2·6H2OⅡ.ZnSO4·7H2OⅢ.(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n (Zn2+)=。
②选用的加料方式是(填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,再升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤完全的依据是。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。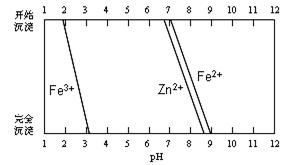
实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1稀硫酸,加入(选填字母,下同)。
A.30%H2O2 B.新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入。
A.纯锌粉B.纯碳酸钙粉末C.纯ZnO粉末D.3mol·L-1稀硫酸
③加热到60℃左右并不断搅拌。
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是。
(15 分)K3[Fe(C2O4)3]· 3H2O(三草酸合铁酸钾晶体)为翠绿色晶体, 溶于水, 难溶于乙醇, 110℃下失去结晶水,230℃分解;是制备负载型活性铁催化剂的主要原料。 实验室利用(NH4)2Fe(SO4)2· 6H2O (硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、30%双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下:
已知:沉淀:FeC2O4 · 2H2O 既难溶于水又难溶于强酸
6FeC2O4 + 3H2O2 + 6K2C2O4 = 4K3[Fe(C2O4)3] + 2Fe(OH)3↓
2Fe(OH)3 + 3H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O
(1)检验硫酸亚铁铵是否变质的试剂是;溶解时加几滴稀硫酸的目的是。
(2)硫酸亚铁铵溶液与 H2C2O4溶液反应生成 FeC2O4 · 2H2O 沉淀,写出该反应方程式;沉淀过滤后,洗涤 1 的操作方法是。
(3)在沉淀中加入饱和 K2C2O4 溶液,并用 40 ℃ 左右水浴加热,再向其中慢慢滴加足量的 30% H2O2溶液,不断搅拌。此过程需保持温度在 40 ℃ 左右,可能的原因是。加入30%过氧化氢溶液完全反应后,煮沸的目的是。
(4)洗涤 2 中所用洗涤试剂最合适的是(填选项字母)。
| A.草酸钠溶液 | B.蒸馏水 | C.乙醇 | D.KCl 溶液 |
(5)为了不浪费药品,95%乙醇水溶液进行回收的方法是,所用的主要玻璃仪器有(任写两种)等。
用钛铁矿(主要含FeTiO3及Fe2O3、SiO2等不溶性杂质)提取高品位TiO2的一种流程如下图所示。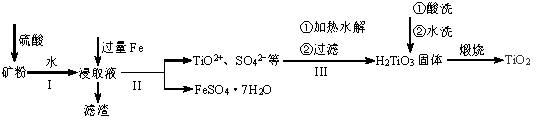
回答下列问题:
(1)有关钛的说法正确的是_________(填字母序号)。
| A.TiOSO4中钛元素的化合价为+4价 |
| B.TiO2中既含有离子键,又含有共价键 |
| C.钛元素位于元素周期表中IVA族 |
| D.在稀有气体氩氛围和800℃条件下,用金属镁与四氯化钛反应可制取金属钛。 |
反应的化学方程式为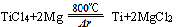
(2)为了从浸取液中获取纯净的FeSO4·7H2O,II中应采取的操作是_________、_________、过滤、洗涤、干燥。如何检验提取FeSO4·7H2O的溶液中存在Fe2+_________。
(3)III中生成H2TiO3的离子方程式是__________________。
(4)将TiO2与焦炭混合,通入氯气在1173K下反应,然后将生成的TiCl4与CO分离可制取TiCl4。此反应中,氧化剂与还原剂物质的量之比是___________。TiCl4极易水解,利用此性质又可制备纳米级二氧化钛TiO2·XH2O,该反应的化学方程式是__________________。
(5)将TiO2熔于NaF 制成熔融盐,以石墨为阴极、覆盖了氧渗透膜的多孔金属陶瓷涂层为阳极,用如图所示电解装置制取金属钛。阳极电极反应式是__________________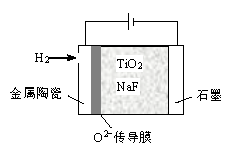
某实验小组的同学为了探究CuSO4溶液与Na2CO3溶液的反应原理并验证产物,进行如下实验。
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,
过滤、冷水洗涤、低温干燥,得到蓝绿色固体。该小组同学猜想此固体为xCuCO3·yCu(OH)2。
(1)为了验证猜想,先进行定性实验。
(2)为进一步确定蓝绿色固体的组成,使用如下装置再进行定量实验。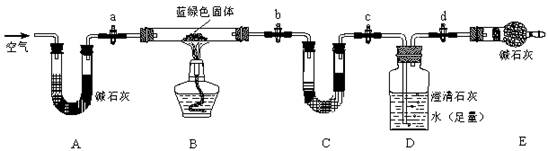
实验Ⅲ:称取5.190g样品,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置C和D中。
①装置C中盛放的试剂是________________,装置E的作用是____________________,反应结束时要通入适量的空气,其作用是____________________________________。
②实验结束后,测得装置C增重0.270g,装置D增重1.320g。则该蓝绿色固体的化学式为____________。
(3)若x=y=1,写出CuSO4溶液与Na2CO3溶液混合时反应的化学方程式______________。
(4)已知20℃时溶解度数据:S[Ca(OH)2] =" 0.16" g,S[Ba(OH)2] =" 3.89" g。有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液,其可能的依据之一是_________________________。
(5)有同学为了降低实验误差,提出如下建议,其中合理的是______(填字母序号)。
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置