下图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中,正确的是
| A.溶液中的氢氧根离子向b电极移动 |
| B.工作一段时间后电解液的pH减小 |
| C.a电极的电极反应式为:CO+2OH-—2e-=CO2+H2O |
| D.用该电池作电源电解饱和食盐水,若溶液中产生0.1mol氢氧化钠,则至少消耗CO的体积为1.12 L |
一定温度下,下列溶液的离子浓度关系式正确的是
| A.任何条件下,pH=13的氢氧化钠溶液中:c(OH-)=0.1mol/L |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C.pH=2的弱酸H2C2O4溶液与pH=12的强碱NaOH溶液混合:c(Na+)+c(H+)=c(OH-)+c(HC2O) |
| D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
室温下,下列各组离子能大量共存的是
A.pH=1的溶液中:Fe2+、NO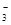 、SO 、SO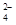 、Na+ 、Na+ |
| B.Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
C. =10-13mol·L-1溶液中:Fe3+、NH4+、Mg2+、 SO42- =10-13mol·L-1溶液中:Fe3+、NH4+、Mg2+、 SO42- |
| D.通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol·L-1,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是
| A.产生气体体积 ①=② |
| B.溶液的pH变化:①减小,②增大 |
| C.电极反应式:①中阳极:4OH- - 4e- →2H2O+O2↑②中负极:2H++2e-→H2↑ |
| D.①中阴极质量增加,②中正极质量减小 |
常温下,下列有关电解质溶液中微粒的物质的量浓度的关系正确的是
| A.向0.1 mol·L-1NH4 Cl溶液中通入大量氨气:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.0.1 mol·L-1的醋酸与0.01 mol·L-1的醋酸相比,前者[H+]大于后者[H+]的10倍 |
| C.已知Ka(HF)=7.2×10-4,Ka(HCN)=4.9×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 |
| D.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol·L-1 |
下列图示与对应的叙述相符的是
| A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0 |
B.图乙代表等物质的量的气体A和B,在一定温度下发生反应A(g)+B(g) 2C(g),达到平衡后,只改变反应的一个条件,其在20~40 min之间的平衡常数不相等 2C(g),达到平衡后,只改变反应的一个条件,其在20~40 min之间的平衡常数不相等 |
| C.图丙表示该反应为放热反应,且催化剂不能改变反应的焓变 |
| D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 |