草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:
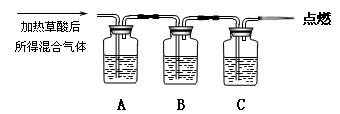
A、乙醇 B、 C、NaOH溶液。
(1)B中盛装的试剂 (填化学式)
(2)A中加入乙醇的目的是 。
(二)探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是 (用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理: MnO4- + H2C2O4+ = Mn2+ + CO2↑+ H2O
(1)配平上述离子方程式。
(2)滴定时KMnO4溶液应盛装于 (填“酸式”或“碱式”)滴定管中。
Ⅱ、探究影响化学反应速率的因素
| 实验 组别 |
c(H2C2O4) /(mol/L) |
V(H2C2O4) /ml |
c(KMnO4) /(mol/L) |
V(KMnO4) /ml |
c(H2SO4) /(mol/L) |
褪色所需时间 |
实验 目的 |
| 1 |
0.2 |
2 |
0.0025 |
4 |
0.12 |
6'55'' |
(a) |
| 0.2 |
2 |
0.005 |
4 |
0.12 |
5'17'' |
||
| 0.2 |
2 |
0.01 |
4 |
0.12 |
3'20'' |
||
| 0.2 |
2 |
0.02 |
4 |
0.12 |
9'05'' |
||
| 0.2 |
2 |
0.03 |
4 |
0.12 |
11'33'' |
||
| 0.2 |
2 |
0.04 |
4 |
0.12 |
14'20'' |
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是 ;
(2)根据表中数据在坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图像;
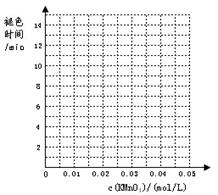
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是 。
18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫酸100 ml,实验操作如下:
(1)计算并用量筒量取ml的18.0 mol·L-1的浓硫酸;
(2)将沿烧杯内壁慢慢注入盛有少量的烧杯中;
(3)将已冷却至室温的硫酸溶液沿玻璃棒注入___________;
(4)用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
(5)继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处,改用胶头滴管逐滴加蒸馏水,至液面与刻度线相切
(6)盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签保存。
试分析下列操作对实验结果的影响(偏高、偏低或无影响)
(1)没有洗涤烧杯和玻璃棒
(2)定容时俯视读数
(3)容量瓶使用前有少许水残留
右图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略 ),其原理与教材中的实验完全相同。
),其原理与教材中的实验完全相同。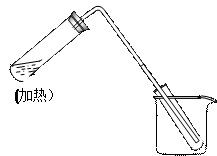
回答下列问题:
(1)左边大试管中要加入几片碎瓷片,其作用是
(2)该装置中使用的玻璃管较长,其作用是
(3)烧杯中还应该加入的物质是
实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
(1)溶解时
(2)过滤时
(3)蒸发时
可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒
(2)除去NaCl晶体中混有的碘单质
(3)分离石油中各不同沸点范围的成分
(4)分离水和苯的混合物
CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H2O)4]2++4C1一 [CuCl4]2- +4H2O
[CuCl4]2- +4H2O
蓝色黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
⑴
⑵。