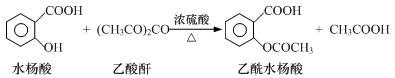
B.[实验化学]工业上常用水杨酸与乙酸酐反应制取解热镇痛药阿司匹林(乙酰水杨酸)。
【反应原理】
【物质性质】
| 试剂 |
沸点(℃) |
溶解度 |
化学性质 |
| 水杨酸 |
211 |
微溶于冷水,易溶于热水 |
|
| 乙酸酐 |
139 |
在水中逐渐分解 |
|
| 乙酰水杨酸 |
|
微溶于水 |
与碳酸钠反应生成水溶性盐 |
【实验流程】
(1)物质制备:向125 mL的锥形瓶中依次加入4 g水杨酸、10 mL乙酸酐(密度为1.08g/mL)、0.5 mL浓硫酸,振荡锥形瓶至水杨酸全部溶解,在85℃~90℃条件下,用热水浴加热5~10 min。
①加入水杨酸、乙酸酐后,需缓慢滴加浓硫酸,否则产率会大大降低,其原因是 。
②控制反应温度85℃~90℃的原因 。
(2)产品结晶:取出锥形瓶,加入50 mL蒸馏水冷却。待晶体完全析出后用布氏漏斗抽滤,再洗涤晶体,抽干。简要叙述如何洗涤布氏漏斗中的晶体? 。
(3)产品提纯:将粗产品转移至150 mL烧杯中,向其中慢慢加入试剂X并不断搅拌至不再产生气泡为止。进一步提纯最终获得乙酰水杨酸3.6 g。
①试剂X为 。
②实验中乙酰水杨酸的产率为 (已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180)。
(4)纯度检验:取少许产品加入盛有5 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色,其可能的原因是 。
下图是教师在课堂中演示的两个实验装置(铁架台等辅助仪器略去)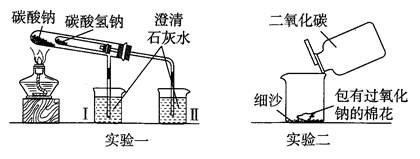
请回答下列问题:
(1)实验一的实验目的是,实验过程中可以观察到烧杯中的现象是
,加热后试管中发生反应的化学方程式是:。
(2)实验二用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花燃烧。通过该实验可以得出许多结论,请你写出由该实验得出的两个结论。
结论1:;
结论2:。
为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装
成实验装置:(提示:在验证CO2之前须先除尽SO2)
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接,接,接;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中____,丙中______;
(3)丁中酸性KMnO4溶液的作用是;
(4)写出甲中反应的化学方程式。
实验室用18.4 mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸。
(1)所需仪器除了玻璃棒、烧杯、胶头滴管 、量筒外,还需要哪个仪器才能完成该实验,请写出:。
(2)计算所需浓硫酸的体积为________ mL 。现有①10mL ②50mL ③100mL三种规格的量筒,应当选用___________。(填序号)
(3)实验中两次用到玻璃棒,其作用分别是:___________、__________。
(4)下列对容量瓶及其使用方法的描述中正确的是_____。
| A.容量瓶上标有容积、温度和浓度 |
| B.容量瓶用蒸馏水洗净后,必须烘干 |
| C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线 1~2 cm处,改用胶头滴管加蒸馏水至刻度线 |
| D.使用前要检查容量瓶是否漏水 |
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有_______。(填序号)
①未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中。
③转移前,容量瓶中含有少量蒸馏水。
④定容时,仰视刻度线。
1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于醇、醚,熔点5.5 ℃,沸点267.4 ℃。1-乙氧基萘常用作香料,也可作为合成其他香料的原料。实验室制备1-乙氧基萘的过程如下: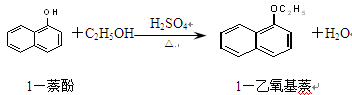
(1)将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是。烧瓶上连接长直玻璃管的主要作用是。
(2)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏②水洗并分液③用10%的NaOH溶液碱洗并分液④用无水氯化钙干燥并过滤。正确的顺序是。
A.③②④①B.①②③④ C.②①③④
(3)蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有。
(4)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高1-乙氧基萘的产量下降的原因可能是、。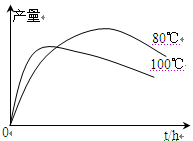
(5)用金属钠可检验1-乙氧基萘是否纯净,简述实验现象与结论:。
依据氧化还原反应:2Fe3+(aq) + Fe(s) ="=" 3Fe2+(aq),设计原电池并完成如图所示实验。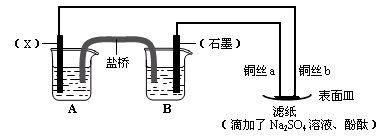
请回答下列问题:
⑴电极X的材料是;石墨电极为电池的 极。
极。
⑵B装置中发生的电极反应方程式为;表面皿中溶质Na2SO4的作用是。
⑶铜丝b与滤纸接触处的现象为;此处电极反应方程式为:。