实验室用18.4 mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸。
(1)所需仪器除了玻璃棒、烧杯、胶头滴管 、量筒外,还需要哪个仪器才能完成该实验,请写出: 。
(2)计算所需浓硫酸的体积为________ mL 。现有①10mL ②50mL ③100mL三种规格的量筒,应当选用___________。(填序号)
(3)实验中两次用到玻璃棒,其作用分别是:___________、__________。
(4)下列对容量瓶及其使用方法的描述中正确的是_____。
| A.容量瓶上标有容积、温度和浓度 |
| B.容量瓶用蒸馏水洗净后,必须烘干 |
| C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线 1~2 cm处,改用胶头滴管加蒸馏水至刻度线 |
| D.使用前要检查容量瓶是否漏水 |
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有_______。(填序号)
①未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中。
③转移前,容量瓶中含有少量蒸馏水。
④定容时,仰视刻度线。
为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
(1)实验目的:分析铁与浓硫酸在加热条件下的反应。
①洗气瓶中浓硫酸的作用是。
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式。
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验。
(2)实验目的:检验气体的成分。
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰。
仪器如下图(可重复使用,可根据需要取用);
①连接仪器。将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氧气,实验过程中能观察到的现象是。
(3)实验目的:确定产物的含量。
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有。
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe3+可采用的试剂为;如果该过程中共消耗了11.2g铁,反应后的溶液能吸收标准状况下1.12L氯气,则原溶液中含有Fe3+的物质的量为mol。
某课外小组模拟上述部分过程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)
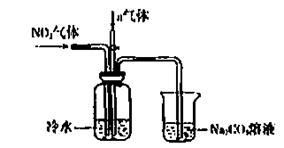
(1)工业上用氨气制取NO的化学方程式是。
(2)连接好装置后,首先进行的操作是。
(3)通入a气体的目的是.
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是
2NO2+Na2CO3=====NaNO2++
(5)已知:温度低于21.15°C时,NO2几乎全部转变为N2O2。工业上可用N2O4与水反应来提高硝酸产率。N2O4与a气体在冷水中生成硝酸的化学方程式是。 (6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K=。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为。
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K=。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为。
(每空2分,共12分)某校化学研究性学习小组的同学在学习了金属的知识后,为了解Cu的常见化合物性质,运用类比学习的思想提出 如下的问题,探究。请你协助该小组的同学完成下列研究。
如下的问题,探究。请你协助该小组的同学完成下列研究。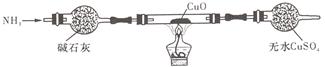
【提出问题】
①Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?③CuO能被H2、CO等还原,也 能被NH3还原吗?
能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有:CuSO4溶液、_________(填试剂),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器还有红色固体存在。据些可推得,A的化学式为_____。
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
实验中观察到CuO变为红色物质,无水CuSO4变____色。同时生成一种对大气无污染的气体。
【实验结论】
(1)Cu(OH)2具有两性,证明Cu(OH)2具有两性的实验现象应是____________________________________。
(2)根据“实验方案(2)”,得出的+1价Cu和+2价Cu稳定性大小的结论是__________________________________。
【问题讨论】
(1)有同学认为NH3与CuO反应生成的 红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质
红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质 是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A______________________________________________________。
是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A______________________________________________________。
(每空1分,共9分)纯碱、烧碱等是重要的化工原料。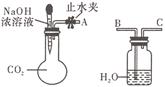
(1)利用如图所示装置可证明二氧化碳与烧碱溶液发生了
反应。将A与B连接,打开止水夹,将胶头滴管中的液体
挤入烧瓶,此时的实验现象是______________________。若其
它操作不变,将A与C连接,可观察到的现象是__________________________________________。 (2)向100mL 2mol/L的NaOH溶液中通入一定量的CO2,结晶,得到9.3g白色固体,该白色固体
(2)向100mL 2mol/L的NaOH溶液中通入一定量的CO2,结晶,得到9.3g白色固体,该白色固体 的组成是_______(写化学式)。设计实验确认该白色固体中存在的阴离子,试完成下列方案:
的组成是_______(写化学式)。设计实验确认该白色固体中存在的阴离子,试完成下列方案:
| 实验操作 |
实验现象 |
结 论 |
| ①取少量白色固体于试管中,加水溶解,再加足量BaCl2溶液 |
||
| ②过滤,取2mL滤液于试管中,滴加酚酞 |
溶液变红 |
(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
 已知NaHCO3在低温
已知NaHCO3在低温 下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O
下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O
NaHCO3↓+NH4Cl,处理母液的两种方法如下:
①向母液中加入石灰乳,可将其中______循环利用,同时得到融雪剂_____。
②向 母液中通入NH3,加入细小食盐颗粒并降温,可得到NH4Cl晶体。
母液中通入NH3,加入细小食盐颗粒并降温,可得到NH4Cl晶体。
试写出通入NH3后,溶解度较小的酸碳酸盐转变为溶解度较大的碳酸盐的离子方程式_________________________________。
(每空2分,共8分)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种 ,并且互不重复:NH
,并且互不重复:NH 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO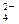 、NO
、NO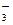 、OH-、CO
、OH-、CO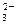 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成
②D和B反应生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)D的化学式是______,判断理由是___________________________________________________________________________。
(2)写出B物质的化学式_____。
(3)写出D和B反应的离子方程式___________________。