本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu的核外电子排布式: 。
(2)SO42—的空间构型是 。
(3)NH3分子中氮原子轨道的杂化类型是 。
(4)氮元素的一种氢化物肼(N2H4)是火箭燃料,则1 molN2H4中含有的σ键的数目为 。
(5)铜的配合物[Cu(CN)4]2-中含有CN-,写出与CN-互为等电子体的一种分子为 (填化学式)。
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为 。

芳香族化合物A有如下图的转化关系: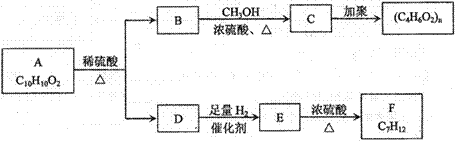
已知D能与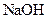 溶液反应,E转化为F时,产物只有一种结构,且能使溴的四氯化碳溶液褪色。请回答下列问题:
溶液反应,E转化为F时,产物只有一种结构,且能使溴的四氯化碳溶液褪色。请回答下列问题:
(1)B的分子式是_____________
(2)A、F的结构简式 A ___________ F __________
(3)写出B→C、E→F的化学反应方程式,并注明反应类型
B→C:_____________________________________________()
E→F:_____________________________________________()
(4)符合下列3个条件的A的同分异构体有多种
①苯环含有对二取代结构②遇FeCl3溶液不变色
③能发生银镜反应
请写出其中任意一种的结构简式________________________________________
已知X、Y和Z三种元素的原子序数之和等于48。X的一种1:1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单位为正方体(如右图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。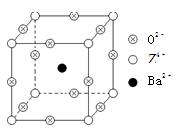
⑴Y在周期表中位于______________;Z4+的核外电子排布式为______________;
⑵X的该种氢化物分子构型为___________,X在该氢化物中以_____________方式杂化。X和Y
形成的化合物的熔点应该_____________(填“高于”或“低于”)X氢化物的熔点。
⑶①制备M的化学反应方程式是________________________________________;
②在M晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的______;
③在M晶体中,Z4+的氧配位数为________;
④已知O2-半径为1.40×10-10 m,则Z4+半径为___________m。
为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下: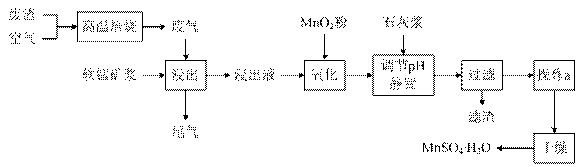
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
7.6 |
9.7 |
| Fe3+ |
2.7 |
3.7 |
| Al3+ |
3.8 |
4.7 |
| Mn2+ |
8.3 |
9.8 |
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式: ________________________。
(2)写出氧化过程中主要反应的离子方程式:______________________。
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是____________。
(4)滤渣的主要成分有____________________________________ _____。
_____。
(5)下列各组试剂中,能准确测定尾气中SO2含量的是__________。(填编号)
a. NaOH溶液、酚酞试液 b. 稀H2SO4酸化的KMnO4溶液
c. 碘水、淀粉溶液d. 氨水、酚酞试液
某化学活动小组设计如图所示装置(部分夹持装置已略去)实验,以探究潮湿的Cl2与Na2CO3反应的产物。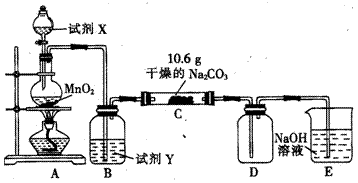
(1)写出装置A中发生反应的化学方程式:__________________________。
(2)写出试剂Y的名称:_______________________________________。
(3)将C中反应后的固体物质分成两等份分装于两支试管中,
①向其中一支试管中加蒸馏水至固体完全溶解后,滴加BaCl2溶液,无明显现象,再滴加NaOH溶液变浑浊,写出产生此现象的离子方程式: ______________;由此现象推断固体产物中含有_____________(填化学式,下同);
②向另一支试管中滴加过量的稀硝酸,有无色无味的气体产生,溶液澄清,再向溶液滴加过量的AgNO3溶液,溶液变浑浊,经过滤、洗涤、干燥,得到7.175g固体,由此现象推断固体产物中含有_____________。
(4)已知C中有0.1molCl2参加反应,D中收集到的气体是氯的一种氧化物。结合(2)中现象及数据可推知,C中反应的化学方程式为__________________________。
D、E为中学化学常见的单质,在一定条件下C、D间能发生反应。各物质转化关系如下图: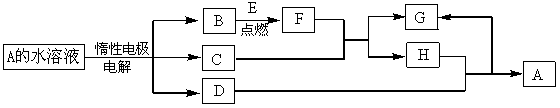
(1)B的同素异形体的名称为:_____________;H的化学式为:_____________。
(2)已知E的燃烧热为QkJ/mol,试写出表示E燃烧热的热化学方程式_____________。
(3)用惰性电极电解A 溶液的阳极反应式为:_____________。
(4)检验H和G的混合溶液中含有G的阳离子的试剂可以是:______ _______。
_______。
a.氯水和KSCN溶液 b.氢氧化钠溶液 c . 酸性KMnO4溶液
. 酸性KMnO4溶液
(5)用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入9.8g含A中金属阳离子的弱碱固体后恰好恢复到电解前的浓度和pH。则电解过程中转移电子的物质的量为_____________mol, 收集到标准状况下的气体体积为_____________。