【化学与技术】氯碱工业是最基本的化学工业之一,它的产品应用广泛。请回答下列问题:
(1)氯碱工业是利用电解食盐水生产 为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入下列试剂的顺序合理的是 (填下列各项中序号)。
a、碳酸钠、氢氧化钠、氯化钡 b、碳酸钠、氯化钡、氢氧化钠
c、氢氧化钠、碳酸钠、氯化钡 d、氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 |
NaCl |
Mg(OH)2 |
CaCO3 |
BaSO4 |
其他不溶物 |
| 质量分数(%) |
15~20 |
15~20 |
5~10 |
30~40 |
10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。
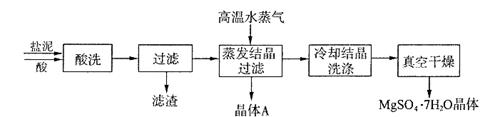
回答下列问题:
①酸洗过程中加入的酸为 ,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 。
②过滤所得滤渣的主要成分为 。
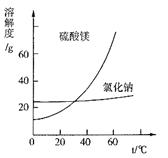
③根据图分析,蒸发结晶过滤所得晶体A主要成分为 。
④真空干燥MgSO4·7H2O晶体的原因是 。
除去高压锅炉用水中溶解的氧气,常用的试剂有N2H4(肼)、Na2SO3。
(1)写出两种试剂和O2反应的化学方程式:
①;②。
(2)除去等质量的O2,所耗N2H4(摩尔质量为32g/mol)、Na2SO3(摩尔质量为126g/mol)质量之比为。
(3)和N2H4相比,使用Na2SO3除氧的缺点是。
(1)将一束灼热的细铜丝立刻放进盛有氯气的集气瓶中,产生的现象是,反应的方程式是。若将一束擦亮的细铜丝伸进装有硫蒸气的大试管内,产生的现象是,反应的方程式是,由此得出Cl2与S的氧化性比较是。
(2)某学生在做铜丝在硫蒸气中燃烧的实验时,先将铜丝用砂纸磨光,在酒精灯上预热后迅速插入试管内靠近熔化的硫的液面上方,结果未见铜丝燃烧。实验失败的可能原因是:①,②。
(3)汞蒸气有毒。①万一把汞洒出,可以在溅洒有微细汞滴的部位撒一层硫磺粉,这时发生反应的化学方程式是:。②室内有汞蒸气时,应进行通风以降低汞蒸气浓度,这时通风口装在墙的(填“上”或“下”)部的效率高。
(4)举出两个实验事实,说明氧的非金属性比氟弱:①;②。
在下图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶。
(1)若A为HCl气体,B为石蕊试液,则形成红色的喷泉。试分析红色喷泉形成的原因。
(2)请你根据喷泉形成的原理,选择适当的A和B来完成喷泉实验(至少通过三种途径且其中一种喷泉为有色)。将你的选择填入下表。
| A |
B |
喷泉颜色 |
|
| 途径1 |
|||
| 途径2 |
|||
| 途径3 |
(3)已知气体压强p、体积V、温度T、物质的量n之间的关系可用克拉珀龙方程式表示:pV=nRT(R为常数).你能否根据此关系再找出能够完成喷泉实验的其他条件?
图2-27为短周期元素组成的中学常见A—J 10种物质的转换关系。已知A、B、C、D均为单质,通常状况下只有A、C、D为气态。它们在一定条件下发生图示化学反应,得到E—J等化合物(图中物质的状态均为常温常压下)。
图2-27
有关反应的化学计量关系为:
①A与B按物质的量之比n(A)/n(B)=1/2完全反应生成G
②B与C按物质的量之比n(B)/n(C)=3/1完全反应生成F
③C与D按物质的量之比n(C)/n(D)=1/3完全反应生成E
请填空:
(1)构成上述物质各元素的离子中,电子层结构相同且按其离子半径由大到小排列的顺序是(用离子符号表示)_______________。
(2)物质G的电子式是____________,其化学键类型是____________。
(3)B和C反应生成F的化学方程式为______________________________________________。
(4)实验室中制取E反应的化学方程式为____________________________________________,干燥E时常用干燥剂的名称是____________。
(5)常温下将F投入J中可生成E和一种白色难溶物X,该反应的化学方程式为
______________________________________________;若将I通入J中可生成H和某物质Y,X与Y溶液可发生中和反应,该反应的离子方程式为_________________________________。
A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8 g B的氢氧化物恰好能与100 mL 2 mol·L-1盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍。根据上述条件完成下列问题:
(1)元素C位于第________周期第________族,它的最高价氧化物的化学式为________。
(2)A元素是________,B元素是________,D元素是________。
(3)A与D形成稳定化合物的化学式是________,该化合物中存在化学键类型为________,判断该化合物在空气中是否变质的简单方法是
________________________________________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为______________________________________________________________________________。