工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如下:

(1)向溶液X中加入铁屑的作用是______ ,此操作中不能加入过量铁粉的原因是______。
(2)检验溶液Z中阴离子的操作方法是______。
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:______。
(4)实验室中制取SO2的原理为: ,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是______。制取SO2的装置,最好选用下图中的______。
,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是______。制取SO2的装置,最好选用下图中的______。

(5)粗硒中硒的含量可用如下方法测定:
 通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol
通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol 的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。
的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。
(13分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。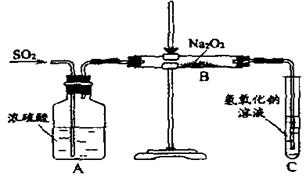
请 回答下列问题:
回答下列问题:
(1)、请写出Na2O2的电子式:;
第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,
该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
上述方案是否合理?。请简要说明两点理由:
①;②。
某校化学兴趣小组用如下装置图验证NO2的氧化性和NO的还原性。
请回答下列问题:
(1)写出甲中反应的离子方程式:;
(2)说明NO2具有氧化性的现象是;
(3)说明NO具有还原性的操作和现象是;
(4)小组一成员对实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是;
经小组讨论,他们设计了以下方案,其中合理的是。
A.NO2与HCl气体混合 B.NO2与H2S气体混合 C.NO2通入Na2S溶液中
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。http://photo.blog.sina.com.cn/showpic.html - blogid=515359c40100g2jm&url=http://static1.photo.sina.com.cn/orignal/515359c4g79a02cb3d130&690http://photo.blog.sina.com.cn/showpic.html - blogid=515359c40100g2jm&url=http://static12.photo.sina.com.cn/orignal/515359c4g79a02bac230b&690
(1)完成以下实验设计表(表中不要留空格)。
| 实验 编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
||||
| ③ |
298 |
10 |
6.0 |
0.30 |
[数据处理]实验测得p—CP的浓度随时间变化的关系如下图。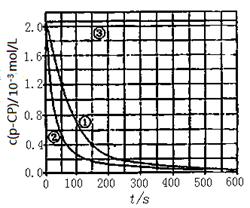
(2)请根据上图实验①曲线,计算降解反应在50~150s内的平均反应速率;v(p—CP)= mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,该降解反应速率增大。但温度过高时(如接近100℃)反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:。
(4)实验③得出的结论是:pH等于10时,。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
化学实验是实现科学探究的重要途径。请将下列有关实验的问题填写完整。
(1)下图是探究氯气性质的部分实验装置。实验室可用浓盐酸与二氧化锰共热来制取氯气,同时生成二氯化猛(MnC12)和水,该反应的化学方程式为;实验时,A装置中的KI淀粉试纸变蓝色,其原因是;B装置中可观察到的现象是;C装置中NaOH溶液的作用是,有关反应的离子方程式为。
(2)某研究性学习小组的同学用以下仪器组合的装置制取氨气,并探究氨气与氧化铜反应的性
质(已知:2NH3+3CuO
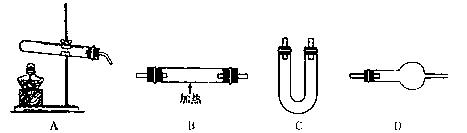
请从上图中选用所需的仪器组成一套装置制取氨气,并使氨气与氧化铜反应,同时证明该反应有水生成。下表是按仪器的连接顺序由上至下依次填写的,请将该表补充填写完整。
| 选用的仪器(填字母) |
加入的试剂 |
作用 |
| 反应器(或发生气体) |
||
| C |
||
| 氧化铜 |
使氨气与氧化铜反应 |
|
某实验小组想验证Mg粉和CO2的反应,请从下图中选用所需的仪器(可重复选用)组成一套进行该实验的装置。现提供浓H2SO4、稀盐酸、镁粉、大理石、澄清石灰水,饱和NaHCO3溶液、饱和Na2CO3溶液。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)。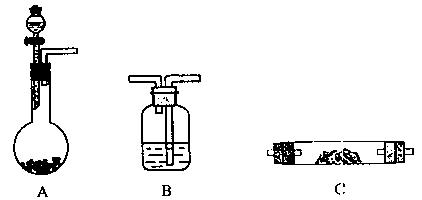
(1)将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加的试剂(可不填满)
| 选用的仪器(填字母) |
加入的试剂 |
| A |
稀盐酸、大理石 |
(2)A中发生反应的离子方程式为。
(3)组装好仪器,检查气密性良好,加入药品。在加热反应管C之前应进行的操作和目的是
。
(4)反应中C装置的主要现象是。