X、Y、Z、Q、R、W为周期表中前四周期的元素,其原子序数依次增大。已知:X的基态原子核外电子有6种运动状态,Y的气态氢化物水溶液呈碱性,Z元素基态原子的s能级与p能级上的电子数相等,Q的一种核素质量数为37,中子数为20,R2+与Z—具有相同的核外电子排布,W原子核外最外层只有1个电子,其余各层均充满电子。回答下列问题:
(1)W在周期表中位于 区,其基态原子价电子排布式为 。
(2)X、Y、Z的第一电离能由大到小的顺序为___ _(用元素符号表示)。
(3)Y、Q两种元素可形成YQ3形化合物,其中心原子杂化方式为 ,分子的空间构型为 。
(4)Y的氢化物易溶解在Z的氢化物中,其原因是 。
(5)已知YZ2+写XZ2互为等电子体,写出YZ2+的电子式 。
(6)Y的一种液态氢化物(Y2H4)与液态Y2Z4发生反应生成Y2(g)和H2Z(l):反应 中若形成1molπ键放热a KJ,写出该反应的热化学方程式 。
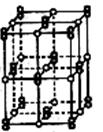
(7)RX2晶体的晶胞结构与NaCl晶体相似(如图示),但RX2晶体中哑铃形X22-的存在,使晶胞沿一个方向拉长。RX2晶体中1个R2+周围距离最近的X22-数目为 。
请将5种物质: 、
、 、
、 、
、 和
和 分别填入下面对应的横线上,组成一个未配平的化学方程式。
分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1)_______+_______——_______+_______+_______+ 。
。
(2)反应物中发生氧化反应的物质是___________,被还原的元素是____________。
(3)反应中1mol氧化剂___________(填“得到”或“失去”)___________mol电子。
(4)请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
□________+□________——
氧化还原反应有多种分类方法,其中根据参与电子转移的元素种类不同的分类方法最常见。下列反应中电子转移发生在相同价态的同种元素之间的有________(填反应编号,下同);电子转移发生在不同价态的同种元素之间的有________;电子转移发生在不同元素之间的有__________。下列反应中转移电子数为 的有_____________。
的有_____________。
① ===
===
 ②
②

 ③
③

 ④
④

⑤ ===
===
 ⑥
⑥

根据图示填空
(1)化合物A中含氧官能团的名称是。
(2)1mol A与2 mol H2反应生成1 mol E,其反应方程式是
___________________________________________________。
(3)B在酸性条件下与Br2反应得到D,D的结构简式是。写出D与NaOH溶液反应的化学方程式_________________________________________。
(4)F的结构简式是。
有A、B、C、D、E五种烃,具有下列性质:①各取0.1mol分别充分燃烧,其中B、C、E燃烧所得的CO2均为4.48L(标准状况),A和D燃烧所得的CO2都是前三者的3倍;②在适宜条件下,A、B、C都能跟氢气发生加成反应,其中A可以转化为D,B可以转化为C,C可以转化为E;③B和C都能使溴水或酸性KMnO4溶液褪色,而A、D、 E无此性质;④用铁屑作催化剂时,A可与溴发生取代反应。判断A、B、C、D、E各是什么物质,写出结构简式:
A___________ B___________ C___________ D____________ E____________
下图是某药物中间体的结构示意图: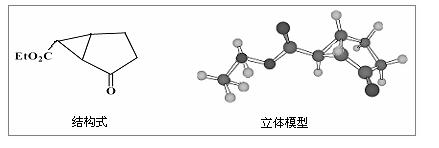
试回答下列问题:
(1)观察上面的结构式与立体模型,通过对比指出结构式中的“Et”表示(填
结构简式);该药物中间体分子的化学式为。
(2)请你根据结构示意图,推测该化合物所能发生的反应类
型。
(3)解决有机分子结构问题的最强有力手段是核磁共振氢谱(PMR)。有机化合物分子中
有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰,吸收峰的面积与氢原
子数目成正比。
现有一种芳香族化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如上图所示,试写出该化合物的结构简式