(15分)三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到。
已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解。实验室制取PCl3的装置示意图和有关数据如下:

| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
| 白磷 |
44.1 |
280.5 |
1.82 |
| PCl3 |
-112 |
75.5 |
1.574 |
| POCl3 |
2 |
105.3 |
1.675 |
请回答:
(1)实验所需氯气可用MnO2和浓HCl反应制取,反应离子方程式为 ,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有 。
(2)实验过程中有以下操作:①加入白磷②打开K2③打开K1④加热,正确的操作顺序为: ,通入CO2的目的是 。E烧杯中加入冷水的目的是 ,干燥管中碱石灰的作用是
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷除去PCl5和过量白磷后,再除去PCl3中的POCl3可用 的方法有制备纯净的PCl3。
(5)①已知亚磷酸(H3PO3)是二元弱酸,PCl3与足量的NaOH溶液反应可生成两种正盐写出反应的化学方程式为 。
②若将0.01 mol POCl3投入热水配成1 L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是 [已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
翰林汇现用MnO2与浓盐酸反应制氯气,再用铜粉和氯气制取少量CuCl2 ,其实验流程示意图如下: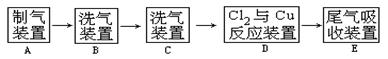
上图中“→”表示气流方向。请完成下列填空。
(1)A 中发生反应的离子方程式为;
(2)B中选用的试剂是;
(3)D装置中的现象为;
(4)若E中的试剂选择KOH溶液,写出相应的吸收反应的化学方程式。
下图是某化工厂对海水资源的综合利用的示意图。
(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是:(填物理变化、化学变化)
(2)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的离子方程式为:。阳极产生气体的如何检验。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐:t。
(3)分离出粗盐的母液中含有Mg2+,从图中可看出对母液进行一系列的加工可制得金属镁。
①在母液中加入石灰乳所起的作用是:。
②从充分利用当地海洋化学资源,就地取材,经济效益的角度考虑,生产生石灰的原料可是:。
③电解熔融氯化镁的化学方程式是:。
④氮气和氩是两种化学性质相对稳定的气体,都可用做白炽灯的填充气体。但工业上冷却电解无水氯化镁所得的镁蒸气时,却选择稀有气体氩。试用化学反应方程式解释不选用氮气的原因:。
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液需要浓盐酸的体积为mL除了烧杯和量筒还需要的仪器有
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)。
| A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡 |
| B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀 |
| C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻线2—3 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是。
(4)若出现如下情况,对所配溶液浓度将有何影响?
加蒸馏水时不慎超过了刻度;定容时俯视_________________________。
(8分)实验室常用氧化浓盐酸的方法制取氯气,课本中实验装置如下图: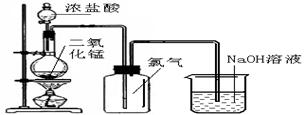
⑴写出制氯气的化学方程式:,
⑵甲同学认为该装置制得的氯气不纯,在收集氯气之前补充了下面实验装置,你认为如何连接(用ABCD字母连接):。浓硫酸的作用,
饱和食盐水的作用是。
(6分)右图所示装置有多种用途,请回答下列问题: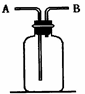
(1)检验:证明CO中混有CO2,装置内应盛
(2)集气:若用排空气法收集比空气轻的气体时,气体应从装置的端通入(填A或B,下同);若收集比空气重的气体,则气体从端通入。