二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题。
(1)实验室可由多种途径制取SO2。
途径I:Na2SO3固体与较浓的硫酸(约70%)反应制取;
途径II:铜与浓硫酸加热制取。
写出途径II的化学反应方程式: 。
若将Cu改为Zn,发现除得到SO2外还有得到一种气体,该气体可能为 。写出生成该气体的离子方程式 。
(2)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。
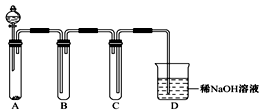
已知:2 KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+8H2O。:
B的作用为: ;
C的作用为: ;
如要得到较为纯净的氯气可怎么改进该装置: 。
(3)某同学设计用如下装置探究二氧化硫、氯气的化学性质。
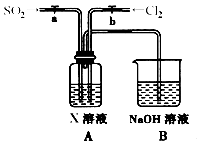
通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:
①若要证明SO2的漂白性,X为 ,操作为 ,现象为 。
②若关闭a,打开b,若X为紫色石蕊试液,则A中的现象为: ,原因是 。
③若同时打开a、b,且通入的气体体积比为1:1,若X为紫色石蕊试液,则A中的现象为 ,与②现象不同的原因是 (书写相应的化学方程式)。
喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。 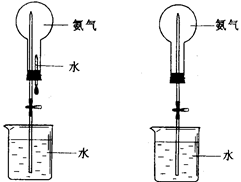

(1)写出实验室制取氨气的化学方程式:。
(2)收集氨气应使用法。
(3)要得到干燥的氨气可选用下列 做干燥剂。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.P2O5固体 |
(4)用图1装置进行喷泉实验,烧瓶已装满干燥氨气,引发水上
喷的操作是。该实验的原理是。
(5)如果只提供如图2的装置,请举例说明引发喷泉法。
某研究性学习小组利用手持技术探究强碱和不同的酸中和反应的过程如下:
(1)实验步骤:
① 分别配制浓度均为0.1mol·L-1的NaOH、HC1、CH3 COOH、H3PO4溶液备用。配制过程中用到的玻璃仪器有烧杯、容量瓶、玻璃棒、细口瓶、、。
② 在锥形瓶中加入10mL0.1 mol·L-1的HC1,在25.00mL(填“酸式”、“碱式”)滴定管中加入0.1 mol·L-1的NaOH,连接数据采集器和pH传感器。
③ 向锥形瓶中滴入NaOH,接近估算的NaOH用量附近时,减慢滴加速度,等读数稳定后,再滴下一滴NaOH。
④存储计算机绘制的pH变化图。用0.1 mol·L-1的CH3 COOH、H3 PO4溶液代替HC1重复上述②~④的操作。
(2)结果分析:20℃时NaOH分别滴定HC1、CH3 COOH、H3 PO4的pH变化曲线如下。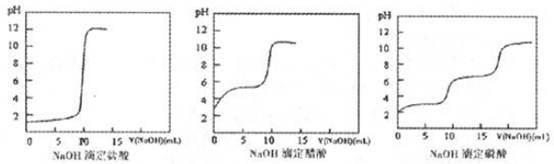
根据上述曲线回答下列问题:
①20℃时,三种酸从强到弱的顺序是;
②滴定开始后醋酸曲线变化比盐酸快的原因是;
③醋酸恰好中和时pH≈8的原因是;
④某同学认为前述的步骤中,NaOH滴定磷酸不可行其原因是 。
分子筛是一种具有立方晶格的硅铝酸盐化合物。分子筛具有均匀的微孔结构,它的孔穴直径大小均匀,这些孔穴能把比其直径小的分子吸附到孔腔的内部,并对极性分子和不饱和分子具有优先吸附能力,因而能把极性程度不同,饱和程度不同,分子大小不同及沸点不同的分子分离开来,即具有“筛分”分子的作用,故称分子筛。由于分子筛具有吸附能力高,热稳定性强等其它吸附剂所没有的优点,使得分子筛获得广泛的应用。某种型号的分子筛的工业生产流程可简单表示如下: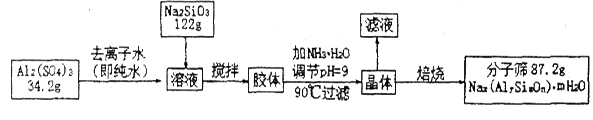
在加NH3• H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成,假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10℅。
(1)分子筛的孔道直径为 称为4A型分子筛,当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65
称为4A型分子筛,当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65 )和异丁烷(分子直径为5.6
)和异丁烷(分子直径为5.6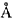 )应该选用型分子筛。
)应该选用型分子筛。
(2)Al2(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为。
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要为。
(4)加NH3·H2O调节pH后,加热到900C并趁热过滤的原因可能是。
(5)该生产流程中所得分子筛的化学式为。
长郡中学某化学兴趣小组设计如图所示的实验装置来探究隔绝空气加热后亚硫酸钠分解后的产物(查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解)。
(1)如何检查上述装置的气密性____________________________________________________。
(2)如果加热温度低于600℃,向所得冷却后固体试样中滴加70%硫酸至足量,在装置B中观察到的现象为_______________________________________________________________,此时A中反应的离子方程式为:______________________________________________。
(3)当加热温度为600℃以上一会儿后,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,同时发现在B中无明显现象,C中发现有黑色沉淀产生,则生成淡黄色沉淀的离子方程式为_________________________________________________。
(4)在(3)中滴加足量稀盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子。请简述检验该离子的方法:____________________________________________________________。
(5)写出Na2SO3固体加热到600℃以上分解的化学方程式:_________________________。
(8分)(1) 某实验室要用90mL1.00 mol·L-1的NaOH溶液。在配制该NaOH溶液的过程中:
①除了要使用托盘天平、药匙、烧杯、玻璃棒、胶头滴管,还要使用的仪器有。
②需用托盘天平称取NaOH的质量为g。
(2)从海带中提取碘的流程如下图: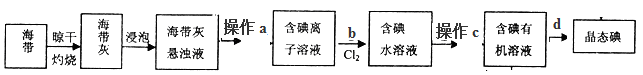
①指出提取碘的过程中实验操作、操作的名称:a__________、c__________
②在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是
。(注:下图试管中深色区为紫红色溶液)