已知25℃时下列酸的电离平衡常数:K(CH3COOH)=1.75×10—5、K(HCN)=6.2×10—10、K1(H2CO3)=4.2×10—7、K2(H2CO3)=5.6×10—11
下列选项不正确的是
| A.过量CO2通入溶液中:2NaCN+H2O+CO2=2HCN+Na2CO3 |
| B.经测定CH3COONH4的水溶液呈中性可知:K(NH3•H2O)=1.75×10—5 |
| C.将等物质的量浓度的CH3COONa与溶液等体积混合后的溶液中:c(CH3COO-)>c(CN-) |
| D.常温下将10ml的PH=3的醋酸溶液稀释到100ml,其PH<5 |
配制一定物质的量浓度的NaOH溶液,下列情况,会使配制的结果偏高的是
A.用滤纸称量NaO H固体 H固体 |
B.未洗涤烧杯和玻璃棒 |
| C.容量瓶中原来含有少量蒸馏水 | D.定容时俯视刻度线观察液面 |
在一定温度下的定容密闭容器中,下列情况表明反应A(s)+2B(g) 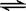 C(g)+D(g) 已达到反应限度的是
C(g)+D(g) 已达到反应限度的是
| A.混合气体的密度保持不变 | B.有1mol C生成的同时有1mol D生成 |
| C.混合气体的总物质的量保持不变 | D.有1 mol A生成的同时有1mol C消耗 |
下列实验操作中有错误的是
A.分液时,分液漏斗下层液体 从下口放出,上层液体从上口倒出 从下口放出,上层液体从上口倒出 |
| B.萃取时,用酒精萃取碘水中的碘 |
| C.蒸馏时,冷却水应从冷凝管的下口通入,上口流出 |
| D.把几滴FeCl3饱和溶液滴入25mL的沸水中加热至液体呈红褐色制取Fe(OH)3胶体 |
废电池必须集中处理的首要原因是
| A.不使电池渗泄的电解液腐蚀其他物品 |
| B.回收其中的石墨电极 |
| C.防止电池中汞、镉、铬、铅等重金属元素形成的有毒化合物对土壤和水源的污染 |
| D.回收其中的各种金属及塑料包装等 |
下列关于物质用途的叙述中不正确的是
| A.工业上利用蛋白质的水解反应生产肥皂和甘油 |
| B.从石油中获得乙烯是工业生产乙烯的主要途径 |
| C.通过海水可以制取氯化钠、镁、烧碱等物质 |
| D.晶体硅是良好的半导体材料,可制成光电池等 |