下列有关热化学方程式的叙述正确的是
| A.已知2H2(g)+O2(g) = 2H2O(g);△H=-483.6kJ/mol,说明2 mol H2(g)和1 mol O2(g)的能量总和小于2 mol H2O(g)的能量 |
| B.已知4P(红磷,s)= P4(白磷,s);△H>0,则红磷比白磷稳定 |
| C.已知OH-(aq)+H+(aq) =H2O(l) ΔH=-57.3 kJ·mol-1,则含20 g NaOH的稀溶液与稀CH3COOH溶液恰好完全中和,放出28.65 kJ的热量 |
| D.己知C(s)+ O2(g)= CO2(g);△H1C(s)+1/2O2(g)= CO(g);△H2则△H1>△H2 |
氧化还原反应的实质是()
| A.得氧和失氧 | B.化合价的升降 | C.有无新物质生成 | D.电子的转移 |
下列关于热化学反应的描述中正确的是()
| A.需要加热才能发生的反应一定是吸热反应 |
| B.1mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热 |
| C.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4Ca(OH)2反应的中和热为2×(-57.3)kJ/mol |
| D.CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程为 |
CO(g)+1/2O2(g)===CO2(g)△H=-283.0kJ/mol
某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L 的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( ) 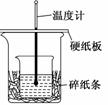
| A.如图条件下实验过程中没有热量损失 |
| B.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求反应热相等 |
| C.图中实验装置缺少环形玻璃搅拌棒 |
| D.烧杯间填满碎纸条的作用是固定小烧杯 |
已知25℃、101 kPa条件下:4Al(s)+3O2(g)===2Al2O3(s),ΔH=-2834.9 kJ/mol;
4Al(s)+2O3(g)===2Al2O3(s),ΔH=-3119.1 kJ/mol。由此得出的正确结论是 ( )
| A.等质量的O2比O3能量低,由O2变O3为放热反应 |
| B.等质量的O2比O3能量高,由O2变O3为吸热反应 |
| C.O3比O2稳定,由O2变O3为放热反应 |
| D.O2比O3稳定,由O2变O3为吸热反应 |
参照反应Br+H2―→HBr+H的能量对反应历程的示意图,下列叙述中正确的是 ( )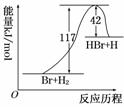
| A.正反应为吸热反应 |
| B.正反应为放热反应 |
| C.加入催化剂,该化学反应的反应热增大 |
| D.从图中可看出,该反应的反应热与反应途径有关 |