已知:
①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
③H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
| A.由①知H2(g)的燃烧热为△H="-571.6" kJ·mol-1 |
| B.由①②可知同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
| C.反应③为中和反应的反应热,由此可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ |
| D.利用盖斯定律可得:3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
青蒿素是一种由青蒿中分离得到的具有新型化学结构的抗疟药,结构如下图所示。有关该化合物的叙述正确的是
| A.分子式为:C16H20O5 |
| B.该化合物在一定条件下不能与NaOH溶液反应 |
| C.青蒿素与维生素一样是水溶性的 |
| D.该化合物中含有过氧键,一定条件下有氧化性 |
芙蓉花色素在不同pH条件下有以下三种存在形式: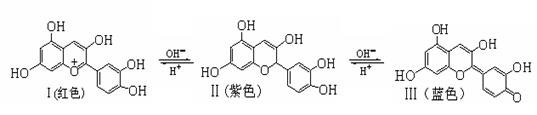
下列有关Ⅰ、Ⅱ、Ⅲ三种化合物的说法不正确的是
| A.由Ⅱ生成Ⅲ发生了氧化反应 | B.Ⅱ和Ⅲ互为同分异构体 |
| C.Ⅱ分子中的所有原子不可能共平面 | D.Ⅰ、Ⅱ和Ⅲ都能和浓溴水反应 |
科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元——苯并呋喃(Z),W是中间产物(R1、R2均为烃基)。则下列有关叙述不正确的是
| A.反应①属于取代反应 |
| B.W中至少含有1个手性碳原子 |
| C.X、Y、W、Z都能与NaOH溶液反应 |
| D.可用溴水或FeCl3溶液鉴别X和W |
酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示。下列对该有效成分的说法正确的是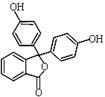
| A.所有原子可能共平面 |
| B.核磁共振氢谱中有7个峰 |
| C.能发生加聚反应生成高分子化合物 |
| D.1 mol该物质最多能与含4molNaOH的烧碱溶液反应 |
天然维生素P(结构如下图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述不正确的是
| A.可与溴水反应,且1 mol该物质与足量溴水反应消耗6 mol Br2 |
| B.可与NaOH溶液反应,1 mol该物质可与4 mol NaOH反应 |
| C.一定条件下1 mol该物质可与H2加成,耗H2最大量为7 mol |
| D.维生素P遇FeCl3溶液发生显色反应 |